
| A.①=②=③=④=⑤ | B.①>④>③>②>⑤ |
| C.⑤>④>①>③>② | D.④>③>⑤>①>② |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
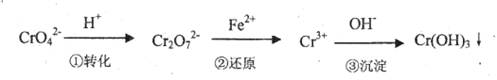
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
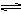 Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为
Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为| A.③①②④ | B.④①②③ | C.①②③④ | D.④③②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl>AgI>Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4> AgCl> >AgI | D.Ag2CrO4> AgI> AgCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变 |
| C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。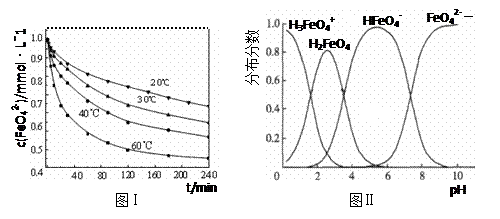
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4+(平衡常数为K1) ②Ag++Cl—
NH4+(平衡常数为K1) ②Ag++Cl— AgCl(平衡常数为K2)
AgCl(平衡常数为K2)  Ag(NH3)2+(平衡常数为K3)
Ag(NH3)2+(平衡常数为K3) | A.氯化银可溶于氨水 | B.银氨溶液中加入少量氯化钠有白色沉淀 |
| C.银氨溶液中加入盐酸无明显现象 | D.银氨溶液可在酸性条件下稳定存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题




 , 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
, 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为| A.Ag2O | B.Ag2CrO4 | C.AgHCrO4 | D.Ag2Cr2O7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com