
分析 处于同一短周期A、B、C、D四种元素,在同族元素中,A的气态氢化物的沸点最高,考虑氢键,有关的元素有O、N、F,可以确定A在第二周期;B的最高价氧化物对应的水化物的酸性在同周期中是最强的,可以确定B是N元素,因为F、O无含氧酸;A是周期表中电负性最强的元素,则A为F元素;C的电负性介于A、B之间,则C为O元素;D与B相邻,则可推知D为碳元素.
解答 解:处于同一短周期A、B、C、D四种元素,在同族元素中,A的气态氢化物的沸点最高,考虑氢键,有关的元素有O、N、F,可以确定A在第二周期;B的最高价氧化物对应的水化物的酸性在同周期中是最强的,可以确定B是N元素,因为F、O无含氧酸;A是周期表中电负性最强的元素,则A为F元素;C的电负性介于A、B之间,则C为O元素;D与B相邻,则可推知D为碳元素.
(1)B的单质为N2,分子中存在三键,分子中存在2个π键,1个σ键,故答案为:2;1;
(2)B的气态氢化物为NH3,很容易与H+结合,此时N原子与H+间形成的键称为配位键,形成的离子立体构型为:正四面体,故答案为:配位键;正四面体;
(3)在A、B、C、D四种元素形成的四种氢化物中的电子数均相同,分别为HF、NH3、H2O、CH4,CH4分子间只有范德华力没有氢键,而NH3、H2O、HF分子间还存在氢键,故沸点最低的是CH4,
故答案为:CH4;CH4分子间只有范德华力没有氢键,而NH3、H2O、HF分子间还存在氢键;
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意氢键对物质性质的影响,难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②①③④ | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 Na2CO3 Ca(OH)2 | B. | HCl NaOH K2CO3 | ||
| C. | H2CO3 C2H5OH Na2SO4 | D. | Ba(OH)2 H3PO4 KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
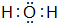 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团) ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯是由乙烯加聚生成的纯净物 | |
| B. | 蛋白质和淀粉水解的最终产物都是氨基酸 | |
| C. | 油脂、纤维素、淀粉在一定条件下均可发生水解反应 | |
| D. | 蛋白质、纤维素、蔗糖都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是制备多种染料和医药的重要中间体,应用极为广泛:用苯、浓硝酸和浓硫酸混合制备硝基苯的装置如图所示:反应物和产物的相关数据列表如下
硝基苯是制备多种染料和医药的重要中间体,应用极为广泛:用苯、浓硝酸和浓硫酸混合制备硝基苯的装置如图所示:反应物和产物的相关数据列表如下| 沸点/℃ | 密度/(g.cm-3) | 水中溶解性 | |
| 苯 | 80.1 | 0.877 | 难溶 |
| 硝基苯 | 210.9 | 1.21 | 难溶 |
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com