
| A. | 相同温度下,溶液中水的电离程度:溶液①<溶液② | |
| B. | 可用Na2CO3固体鉴别0.04mol•L-1醋酸和0.04mol•L-1盐酸 | |
| C. | 向①中加入少量CH3COONa固体,则$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 加水稀释溶液③,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变 |
分析 ①中溶质为0.01mol/L的醋酸、②中溶质为0.01mol/L的醋酸钠、③中溶质为0.01mol/L的醋酸和0.01mol/L的醋酸钠
A.酸或碱抑制水电离,含有弱离子的盐促进水电离;
B.醋酸是弱电解质、HCl是强电解质,相同浓度的醋酸和盐酸中,醋酸中氢离子浓度小于盐酸,二者分别和碳酸钠反应现象不同;
C.向①中加入少量CH3COONa固体,醋酸钠电离出的醋酸根离子而抑制醋酸电离,溶液中醋酸根离子浓度增大,温度不变,醋酸电离平衡常数不变;
D.$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH).c({H}^{+}).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$,离子积常数、弱电解质电离平衡常数都只与温度有关.
解答 解:①中溶质为0.01mol/L的醋酸、②中溶质为0.01mol/L的醋酸钠、③中溶质为0.01mol/L的醋酸和0.01mol/L的醋酸钠
A.酸或碱抑制水电离,含有弱离子的盐促进水电离,①中醋酸抑制水电离、②中醋酸钠促进水电离,所以相同温度下,溶液中水的电离程度:溶液①<溶液②,故A正确;
B.醋酸是弱电解质、HCl是强电解质,相同浓度的醋酸和盐酸中,醋酸中氢离子浓度小于盐酸,二者分别和碳酸钠反应现象不同,可以鉴别,故B正确;
C.向①中加入少量CH3COONa固体,醋酸钠电离出的醋酸根离子而抑制醋酸电离,溶液中醋酸根离子浓度增大,温度不变,醋酸电离平衡常数不变,所以$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$减小,故C错误;
D.$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH).c({H}^{+}).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$,离子积常数、弱电解质电离平衡常数都只与温度有关,所以加水稀释溶液③,溶液中温度不变,则溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变,故D正确;
故选C.
点评 本题考查酸碱混合溶液定性判断、弱电解质的电离等知识点,为高频考点,侧重考查学生分析判断能力,正确理解弱电解质电离平衡常数表达式是解本题关键,注意D中比例式的变形,为难点.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素核外电子总倾向先排满能量较高的电子层,排满后排至能量较低的电子层? | |
| B. | 最外层电子数为1的元素一定是金属元素 | |
| C. | 原子核外M层最多容纳18个电子 | |
| D. | 镁原子与镁离子具有相同的电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| C. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
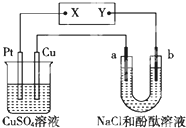
| A. | X是正极,Y是负极 | |
| B. | NaCl溶液中的Cl-移向b极 | |
| C. | CuSO4溶液的pH不变 | |
| D. | 理论上,a和b生成的气体的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com