
����Ŀ��������;�㷺�Ľ���Ԫ�أ����������������ײ����к��ĺ�����ҵ��ˮ��
��1����ԭ�������Ǵ�����Cr2O72����CrO42����ҵ��ˮ��һ�ֳ��÷������乤������Ϊ��CrO42�� ![]() Cr2O72��
Cr2O72�� ![]() Cr3+
Cr3+ ![]() Cr��OH��3��
Cr��OH��3��
���еڢ���ƽ�⣺
2CrO42������ɫ��+2H+Cr2O72������ɫ��+H2O
����ƽ����ϵ��pH=0������Һ��ɫ��
�ڸ���2CrO42��+2H+Cr2O72��+H2O���������ͼװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7 �� Na2Cr2O7�и�Ԫ�صĻ��ϼ�Ϊ �� ͼ���Ҳ�缫���ӵ�Դ��������缫��ӦʽΪ ��
�۵ڢ�Ӧ�����ӷ���ʽ�� ��
��2��CrO3����ǿ�����ԣ������л����ƾ���ʱ�����ҷ�Ӧ�����Ż����ù������Ҵ������������ᣬCrO3����ԭ����ɫ��Cr2��SO4��3 �� ��ɸ÷�Ӧ�Ļ�ѧ����ʽ��
��CrO3+��C2H5OH+��H2SO4�T��Cr2��SO4��3+��CH3COOH+��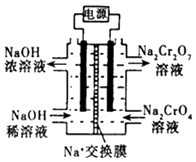
���𰸡�
��1���ȣ�+6������4OH����4e��=O2��+2H2O��6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O
��2��9H2O
���������⣺��1������ƽ����ϵ��pH=0����Һ���Խ�ǿ��ƽ��2CrO42������ɫ��+2H+�TCr2O72�� ����ɫ��+H2O�����ƶ�����Һ�ʳ�ɫ�����Դ��ǣ��ȣ�
���ɻ��ϼ۴�����Ϊ0��֪Na2Cr2O7�и�Ԫ�صĻ��ϼ�Ϊ+6�ۣ�����2CrO42��+2H+Cr2O72��+H2O���ͼʾװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7 �� ��Ҫͨ���������H+�����Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ���������缫��ӦʽΪ4OH����4e��=O2��+2H2O��
���Դ��ǣ�+6��������4OH����4e��=O2��+2H2O��
������������Cr2O72������������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O��
���Դ��ǣ�6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O����2��CrO3����ǿ�����ԣ������л����ƾ���ʱ���Ҵ������������ᣬ̼��ƽ�����ϼ۴ө�2�����ߵ�0��1���Ҵ����ϼ۱仯4��CrO3����ԭ����ɫ�������[Cr2��SO4��3]�����Ļ��ϼ۴�+6�۽��͵�+3�ۣ�1��CrO3���ϼ۱仯3�����ߵ���С��������12���ٸ���ԭ���غ��4CrO3+3C2H5OH+6H2SO4=2Cr2��SO4��3+3CH3COOH+9H2O��
���Դ��ǣ�4��3��6��2��3��9H2O��
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���ʼ����������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾװ����ȡ��ˮ���������ʵ�飮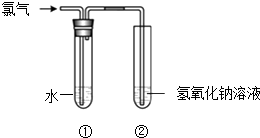
��1��װ�â��з�Ӧ�Ļ�ѧ����ʽ�� �� װ�â��е�NaOH��Һ��������Ҳ������β�����������ã�����ĸ����a��NaCl��Һ b��FeSO4��Һ c��Na2SO3��Һ
��2��ʵ�����һ��ʱ���װ�â�����Һ�ʻ���ɫ���ɴ�˵������Һ��һ�����е����������ѧʽ����
��3��ȡ����װ�â��е���Һ������ɫʯ����ֽ�ϣ���ֽ�ȱ�����ɫ��˵����ˮ�����ԣ�
��4����֪������ͨ���ȵ�����������Һ�У��ɷ������·�Ӧ��Cl2+NaOH��A+NaClO3+H2O��δ��ƽ�����У�A�Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������A��B��C��D��E��F��Gԭ��������������AԪ�ص�����������������ȣ�BԪ�ؾ��������ܼ������ŵ�������ͬ��DԪ��2p�ܼ��ϵ�������2s�ܼ���������D��E������ͬ���壮F�ǵ�������δ�ɶԵ�������ԭ�ӣ�G��Ŀǰʹ�������Ľ��� ��ش��������⣺�����Ƴ���Ԫ�ط��Ż���ѧʽ����
��1��F�ļ۵����Ų�ʽΪ �� B��C��D����Ԫ�صĵ�һ�����ܴӴ�С��˳��Ϊ ��
��2��BD32����Bԭ�ӵ��ӻ���ʽΪ �� �����ӵĿռ乹��Ϊ
��3��д��һ����A��C��D����ҼȺ����Ӽ��ֺ����ۼ������ʵĻ�ѧʽ �� ������ABC�ЦҼ��ͦм���Ŀ֮��Ϊ �� C����̬�⻯����һ����ѹǿ�£���õ��ܶȱȸ�ѹǿ�������ܶ��Դ������ԭ�� ��
��4��E��G�γɵ�ij�־�������ͼ��ʾ�����а����ʾE�������ʾG��������ʵĻ�ѧʽΪ �� ����þ������ܶ�Ϊ�� g/cm3 �� ��NA��ʾ�����ӵ���������þ����о��������Gԭ��֮��ľ���Ϊcm�� 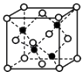
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��c(H+)��С����
A.c(OH��)=1��10��11mol��L��1B.pH=3��CH3COOH��Һ
C.pH=4��H2SO4��ҺD.c(H+)=1��10��3mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ�HC��CH ��C2H5Cl����CH3CH2OH����CH3COOH���ݾ���ϩ���� ![]() ���������У�
����������
��������ˮ������ѧ��Ӧ���������ڸ߷��ӻ����������
������Na2CO3��Һ��Ӧ���������ܷ���������Ӧ������
���ܷ�����ȥ��Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī�缫������е��ʵ�飮
ʵ��һ | ʵ��� | |
װ�� |
|
|
���� | a��d����ֽ������b����죬�ֲ���ɫ��c�������Ա仯 | ����ʯī�缫���������ݲ�����n�������ݲ������� |
���ж�ʵ������Ľ��ͻ��Ʋⲻ�������ǣ� ��
A.a��d����2H2O+2e���TH2��+2OH��
B.b����2Cl����2e���TCl2��
C.c�������˷�Ӧ��Fe��2e���TFe2+
D.����ʵ��һ��ԭ����ʵ�����m��������ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������W��Y����������֮��ΪX��������������2����Z�����������������ڲ��������X��Y��Z�ļ����ӵĵ��Ӳ�ṹ��ͬ��W�ĵ����ǿ�������������������塣����˵����ȷ���ǣ� ��
A.Y������������Ӧˮ��������Ա�W��ǿ
B.W����̬�⻯���X���ȶ�
C.���Ӱ뾶�Ĵ�С˳��r(W)��r(X)��r(Y)��r(Z)
D.XY2��ZY2�еĻ�ѧ��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3�����ѳ�Ϊ�������о����ȵ�֮һ��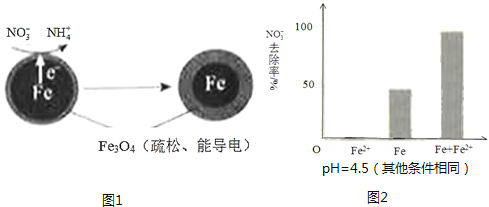
��1��Fe��ԭˮ����NO3���ķ�Ӧԭ����ͼ1��ʾ��
���������������� ��
�������ĵ缫��Ӧʽ�� ��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3����ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3����ȥ���ʵͣ���ԭ���� ��
��3��ʵ�鷢�֣��ڳ�ʼpH=4.5��ˮ����Ͷ���������۵�ͬʱ������һ������Fe2+�����������NO3����ȥ���ʣ���Fe2+������������ּ��裺
��Fe2+ֱ�ӻ�ԭNO3����
��Fe2+�ƻ�FeO��OH�������㣮
�����Ա�ʵ�飬�����ͼ2��ʾ���ɵõ��Ľ����� ��
��ͬλ��ʾ�ٷ�֤ʵFe2+����FeO��OH����Ӧ����Fe3O4 �� ��ϸ÷�Ӧ�����ӷ���ʽ�����ͼ���Fe2+���NO3��ȥ���ʵ�ԭ�� ��
��4�����������루2����ͬ����1Сʱ�ⶨNO3����ȥ���ʺ�pH����������
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | Լ10% | Լ3% |
1СʱpH | �ӽ����� | �ӽ����� |
�루2�������ݶԱȣ����ͣ�2���г�ʼpH��ͬʱ��NO3��ȥ���ʺ���������������̬��ͬ��ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�����£���30mL����������Ļ�������ȼ����ȴ�����£������������Ϊ16mL����ԭ��������м��������������ȣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com