
| A. | 容器内压强不随时间变化而变化 | |
| B. | 单位时间消耗0.1mol X同时生成0.3mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:3 | |
| D. | 容器内各物质的浓度不随时间变化而变化 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.该反应前后气体物质的量之和不变,则无论反应是否达到平衡状态,则压强始终不变,所以不能根据压强判断平衡状态,故A错误;
B.单位时间消耗0.1mol X同时生成0.3mol Z,方向一致,则不能据此判断平衡状态,故B错误;
C.容器内X、Y、Z的浓度之比为1:2:3,该反应不一定达到平衡状态,与反应物初始浓度及转化率有关,故C错误;
D.容器内各物质的浓度不随时间变化而变化时,正逆反应速率相等,该反应达到平衡状态,故D正确;
故选D.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,为易错题.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验Cl-的试剂是硝酸银和硝酸 | |
| B. | 检验SO${\;}_{4}^{2-}$的试剂是氯化钡和盐酸 | |
| C. | 检验CO${\;}_{3}^{2-}$的试剂是盐酸、澄清石灰水和氯化钙 | |
| D. | 向溶液中加入BaCl2溶液后生成白色沉淀,即可证明有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
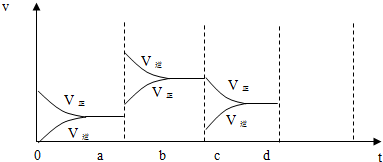
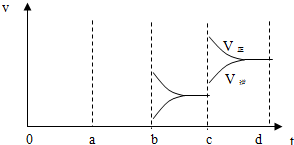 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1mol/L | |
| B. | 在标准状况下,11.2LH2O所含的氢原子数为NA | |
| C. | CO2的摩尔质量为44g | |
| D. | 标准状况下22.4LCH4与l8gH2O所含有的电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)有下列五种烃:
(1)有下列五种烃: ②
② ③乙烷 ④C(CH3)4⑤
③乙烷 ④C(CH3)4⑤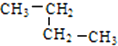 ,其中互为同分异构体的是②④(填序号),②与⑤
,其中互为同分异构体的是②④(填序号),②与⑤ ,E的结构简式为
,E的结构简式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com