
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | 使pH试纸显蓝色的溶液:Cu2+、NO3-、Fe3+、SO42- | |
| C. | 与铝粉反应放出H2的无色溶液:NO3-、Al3+、Na+、SO42- | |
| D. | 常温下$\frac{c({H}^{-})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
分析 A.c(H+)=0.1 mol•L-1的溶液,显酸性;
B.使pH试纸显蓝色的溶液,显碱性;
C.与铝粉反应放出H2的无色溶液,为非氧化性酸或强碱溶液;
D.常温下$\frac{c({H}^{-})}{c(O{H}^{-})}$=1×10-12的溶液,显碱性.
解答 解:A.c(H+)=0.1 mol•L-1的溶液,显酸性,不能大量存在S2O32-,可发生氧化还原反应,故A不选;
B.使pH试纸显蓝色的溶液,显碱性,不能大量存在Cu2+、Fe3+,故B不选;
C.与铝粉反应放出H2的无色溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Al3+,酸溶液中NO3-、Al发生氧化还原反应不生成氢气,故C不选;
D.常温下$\frac{c({H}^{-})}{c(O{H}^{-})}$=1×10-12的溶液,显碱性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子共存,为高考常见题型,侧重于学生的分析能力的考查,把握习题中的信息及常见离子之间的反应为解答该类题目的关键,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:实验题
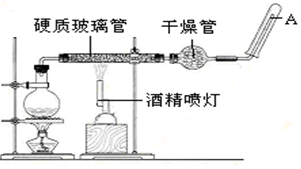
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
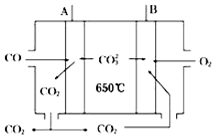 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24 mol/(L•min) | B. | 0.08 mol/(L•min) | C. | 0.06 mol/(L•min) | D. | 0.12 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L含24.5gH2SO4的溶液 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1LH2SO4溶液中含98gH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com