
| A. | 石油液化气的主要成份为甲烷 | |
| B. | 燃料的脱硫、脱氮都是减少酸雨产生的措施 | |
| C. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
分析 A.液化石油气的主要成分是丙烷、丁烷、丙烯(C3H6)、丁烯(C4H8);
B.二氧化硫和氮氧化物是形成酸雨的主要成分;
C.硫酸钡难溶于水,但溶解的硫酸钡都完全电离;
D.蛋白质水解可生成氨基酸.
解答 解:A.液化石油气的主要成分是丙烷、丁烷、丙烯(C3H6)、丁烯(C4H8),所以液化石油气的主要成分不是甲烷,但煤矿坑道气、天然气、沼气、油田气的主要成分是甲烷,故A错误;
B.二氧化硫和氮氧化物是形成酸雨的主要成分,燃料的脱硫、脱氮都能减少二氧化硫、氮氧化物的排放,所以是减少酸雨产生的措施,故B正确;
C.硫酸钡难溶于水,但溶解的硫酸钡都完全电离,所以硫酸钡是强电解质,故C错误;
D.蛋白质在加热条件下变性,在催化剂条件下水解可生成氨基酸,故D错误;
故选B.
点评 本题综合考查物质的结构、性质以及应用,为高考常见题型,侧重于化学与生活、生产的考查,注意把握物质的性质的异同及物质的用途是解本题关键,注意:电解质强弱与其溶解度大小无关,只与其电离程度有关,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
| B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
| C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
| D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂 | |
| B. | ClO2具有还原性,可用于自来水的杀菌消毒 | |
| C. | SiO2硬度大,可用于制造光导纤维 | |
| D. | NH3易溶于水,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH=CH2能发生取代反应,加成反应、氧化反应 | |
| B. | 月桂烯(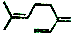 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲烷、乙烯、苯和乙醇都能使酸性KMnO4溶液褪色 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①、②为反应③提供原料气 | |
| B. | 反应③也是 CO2资源化利用的方法之一 | |
| C. | 反应CH3OH(g)═$\frac{1}{2}$CH3OCH3 (g)+$\frac{1}{2}$H2O(l)的△H=$\frac{d}{2}$kJ•mol-1 | |
| D. | 反应 2CO(g)+4H2 (g)═CH3OCH3 (g)+H2O(g)的△H=( 2b+2c+d ) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
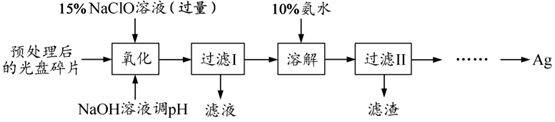
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钾与硫酸的反应 | B. | 锌与盐酸反应放出氢气 | ||
| C. | CO2通过炽热的焦炭发生的反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物能与水反应生成相应的酸 | |
| B. | 室温下,0.05mol•L-1的M的气态氢化物的水溶液的PH>l | |
| C. | 简单离子半径由大到小的顺序:Y>Z>M | |
| D. | Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Z电极上产生大量气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com