
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
| A、8种;2种 |
| B、8种;3种 |
| C、7种;3种 |
| D、7种;2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
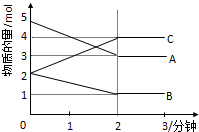 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
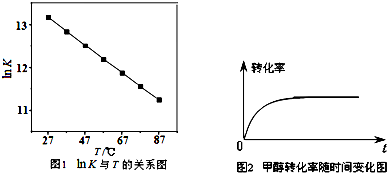
| 时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
| CH2(OCH3)2(mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
| 影响因素 试验号 |
甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率 |
| 1 | 70 | 2.5 | 30 | |
| 2 | 1.0 | |||
| 3 | 2.5 | 80 |
| CH3OH |
| H+ |
| CH3OH |
| -H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的两个实验装置中,均为500mL氯化铜溶液,试回答下列问题:
如图所示的两个实验装置中,均为500mL氯化铜溶液,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行蒸馏操作时先加热再通冷凝水 |
| B、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| C、容量瓶用蒸馏水洗涤后不烘干就使用 |
| D、为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com