

| 0.5mol/L×0.25L×56g/mol |
| 10g |
| ||
| 5.0 |
| 70 |
| 56 |
| 24 |
| 16 |
| ||
| ||


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| O2 |
| 反应① |
| O2 |
| 反应② |
| H2O |
| 反应③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| B、铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+ |
| C、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
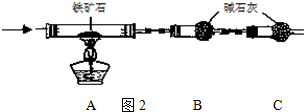
 (1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.
(1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.
| 氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 1.0×10-15 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用带玻璃塞的试剂瓶保存Na2CO3溶液 |
| B、配制FeCl3溶液时,向溶液中加入少量铁粉和稀盐酸 |
| C、在铁件表面镀铜时,用铁件作阴极、铜作阳极、稀硫酸作电镀液 |
| D、实验室进行肥皂反应时,在油脂和氢氧化钠的混合液中加入适量酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
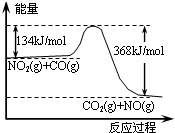
 反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述不正确的是
反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述不正确的是| A、达到平衡后,加入催化剂,C%不变 |
| B、该反应为放热反应 |
| C、化学方程式中m+n>e+f |
| D、达到平衡后,增加A的质量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上常用热的纯碱溶液去除油污 |
| B、接外加电源的正极以保护海水中的钢闸门 |
| C、锅炉水垢中含有的CaSO4可用Na2CO3溶液处理转化为疏松且易溶于酸的CaCO3 |
| D、太阳能、氢能和生物质能等很可能成为未来的主要能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com