
【题目】下列叙述正确的是
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.放热反应不需要从外界吸收任何能量就能发生
C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量
D.物质燃烧不一定是放热反应
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
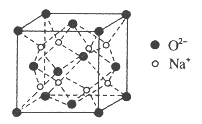
【题目】H、C、N、O、Na、Fe、Cu是常见的七种元素。
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是____________。
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是______(填写序号)。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________,1个分子中含有_________个π键。
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_____________。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长![]() _______cm。(用含ρ、NA的代数式表示)
_______cm。(用含ρ、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于如图所示转化关系(X代表卤素)的说法错误的是

A. ΔH3<0
B. ΔH1=ΔH2+ΔH3
C. 按Cl、Br、I的顺序,ΔH2依次增大
D. ΔH1越小,HX越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( ) 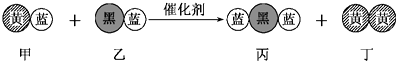
A.该反应属于氧化还原反应
B.甲和丙中同种元素化合价不可能相等
C.丁物质一定是非金属单质
D.配平后甲、乙、丙的化学计量数均为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是 ( )
A | B | C | D | |
反应 装置或 图像 |
|
|
|
|
实验现 象或图 像信息 | 温度计的 水银柱不 断上升 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 反应开始 后,针筒活 塞向右移动 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系图:
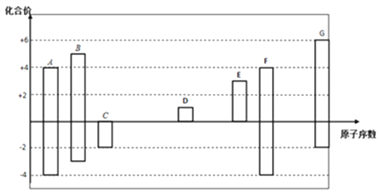
(1)元素A在周期表中的位置_________。
(2)用电子式表示D2G的形成过程_________________。
(3)C、D、G对应的简单离子半径大小顺序是__________(用离子符号回答)。
(4)某同学设计实验装置如图所示,证明A、B、F的非金属性强弱关系:
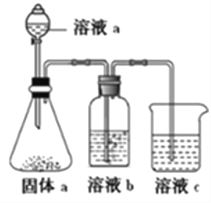
①溶液a和溶液b分别为__________,__________。
②溶液c中的离子反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2) 提取铜的操作流程如图:。
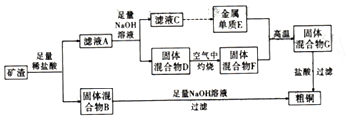
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)铁在元素周期表中的位置为___________;固体混合物B与氢氧化钠溶液反应的离子方程式为___________________。
(2)滤液A中铁元素的存在的离子形式为_______,.理由是_____________(用离子方程式表达,不必书写Cu2O 与盐酸的反应)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用多种试剂,请写出用最佳方案反应的离子方程式:_______________。
(4)工业上利用电解法进行粗铜精炼时,下列叙述正确的是______ (填序号)。
a.电解过程中,阳极质量的减轻量一定等于阴极质量的增加量
b.粗铜接电源正极,发生氧化反应
c.电解过程中,粗铜中所有杂质均被氧化
d.电解精炼过程中可以用硝酸银溶液作电解质溶液
(5)取320g固体混合物F 于硬质玻璃管中,通入足量氢气充分加热还原,固体质量减轻80g,若将所得的还原产物与足量稀盐酸反应,产生的H2在标准状况的体积为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,能完成很多电化学实验.下列有关此装置的叙述中,不正确的是( ) 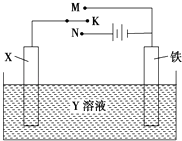
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流阴极保护法
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:x A(g)+yB(g)pC(g)+qD(g)已知:平均反应速率Vc= ![]() Va , 反应2min时A的浓度减少了
Va , 反应2min时A的浓度减少了 ![]() ,B的物质的量减少了
,B的物质的量减少了 ![]() mol,有a mol D生成.回答下列问题:
mol,有a mol D生成.回答下列问题:
(1)化学反应方程式中,x= , y= , p= , q=
(2)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol 则该反应的△H0;(填“>、<或=”)
(3)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较: ①反应速率(填:“增大”“减小或“不变”).
②平衡时反应物的转化率(填:“增大”“减小或“不变”)理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com