
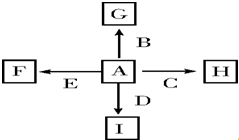
 图中A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.
图中A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.分析 A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G$\frac{\underline{\;高温\;}}{\;}$B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I$\frac{\underline{\;点燃\;}}{\;}$2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
然后结合元素化合物知识及化学用语来解答.
解答 解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G$\frac{\underline{\;高温\;}}{\;}$B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I$\frac{\underline{\;点燃\;}}{\;}$2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
(1)①中反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)I为二氧化碳,其化学式为CO2,故答案为:CO2;
(3)C与过量NaOH溶液反应的化学方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后溶液与过量化合物Ⅰ反应的化学方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓、CO2+OH-=HCO3-,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(4)E在I中燃烧可能观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳,
故答案为:镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳.
点评 本题考查无机物的推断,注意利用铝热反应及温室效应气体、Mg与二氧化碳的反应为解答本题的突破口,熟悉Mg、Al及其化合物的性质及氧化还原反应即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O的分子数为 NA | |
| B. | 常温常压下,1mol甲基(-CH3)所含的电子数为10NA | |
| C. | 2.3g金属钠反应生成Na2O2时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙炔和苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛( HCHO)和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开展煤的综合利用 | B. | 开发和利用太阳能 | ||
| C. | 推广使用无氟冰箱 | D. | 用火力发电代替风力发电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Na2O2是氧化剂,CO2是还原剂 | |
| B. | 1mol Na2O2参加反应,有2mole-转移 | |
| C. | Na2O2晶体中阴阳离子个数比为1:1 | |
| D. | Na2O2晶体中含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 升温可让吸热反应加快速率,而会让放热反应减慢速率 | |
| D. | 通过增大浓度、升高温度、增大压强都可以使反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com