
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:选择题
下列有关溶液的叙述中,正确的是( )
A.中和10 mL 0.1 mol·L-1 醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同
B.常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7
C.常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等
D.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:选择题
每摩尔物质含有
A.6.02×1023个分子 B.6.02×1023个原子
C.阿伏加德罗常数个原子 D.阿伏加德罗常数个该物质的粒子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为______________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
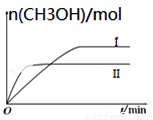
①该反应的平衡常数的表达式为K=___ ____。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ _KⅡ(填“大于” 、“等于”或“小于”)。
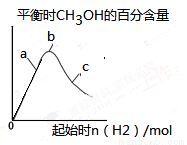
③在下图a、b、c三点中,H2的转化率由高到低的顺序是__________(填字母)。
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)在恒温恒容条件下,起始加入的反应物不变,要增大CH3OH 的产率,可以采取的有效措施是
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
甲醇质子交换膜在燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1=+49.0 kJ/mol
②CH3OH(g)+O2 (g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
根据上述反应,下列说法正确的是
A.反应①中的能量变化如图所示
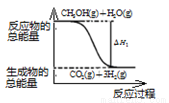
B.CH3OH转变成H2的过程一定要吸收能量
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.可推知2H2(g)+O2(g)=2H2O(g)ΔH=-483. 8 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
实验室制取Cl2的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,下列说法正确的是
MnCl2+Cl2↑+2H2O,下列说法正确的是
A.氧化剂是HCl,还原剂是MnO2
B.每生成2 mol Cl2,转移电子的物质的量是4 mol
C.每消耗1 mol MnO2,表现还原作用的HCl为4 mol
D.Cl2既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北邢台一中高二上学期期中测试化学试卷(解析版) 题型:选择题
具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
A.两种原子的电子层上全部都是s电子
B.3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子
C.最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子
D.原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高二上12月月考化学卷(解析版) 题型:填空题
(1)有下列物质①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦BaSO4属于弱电解质的是________________(填序号);
(2)常温下,0.1 mol•L-1NaHCO3溶液的pH大于8,则溶液中的Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________;NaHCO3水解的离子方程式为_____________;
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA是强酸还是弱酸____________;
②b组情况表明,c_____0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)_________c(Na+);(选填“>”、“<”或“=”)
③a组实验所得混合溶液中由水电离出的c(OH-)=_______mol•L-1。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:填空题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:
N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=______________kJ•mol-1
②用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是___________________。
(2)污水中的NH4+可以用氧化镁处理,发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2++2NH3•H2O
Mg2++2NH3•H2O
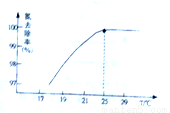
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是___________________。
②剩余的氧化镁,不会对废水形成二次污染,理由是___________________。
(3)污水中的含氮化合物,通常先用生物脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H++H2O;2HNO2+O2=2HNO3),然后加入甲醇,NO3-和甲醇转化为两种无毒气体。
①上述方法中,14g铵态氮元素转化为硝态氮元素时需氧的质量为_____________g。
②请写出加入甲醇后反应的离子方程式___________________。
(4)甲醇燃料电池的工作原理如下图所示,则该电池负极的电极反应式为_________。
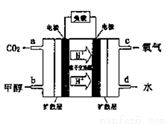
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com