
分析 (1)存在的分子有H2O、H2A,则H2A为弱酸;
(2)等体积混合生成Na2A,水解显碱性,离子水解以第一步为主;由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp可得c(Ba2+);
(3)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,以此分析.
解答 解:(1)存在的分子有H2O、H2A,则H2A为弱酸,电离方程式为H2A?H++HA-、HA-?H++A2-,故答案为:H2A?H++HA-、HA-?H++A2-;
(2)等体积混合生成Na2A,水解显碱性,pH>7,离子水解以第一步为主,则离子浓度关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp=c(Ba2+)•c(A2-)可得c(Ba2+)=$\frac{{K}_{sp}}{c({A}^{2-})}$=$\frac{\frac{1.8×1{0}^{-10}}{1}}{3}$
=5.4×10-10 mol•L-1;
故答案为:>;c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);5.4×10-10;
(3)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,H2A为弱酸,pH=3的H2A溶液与pH=11的NaOH溶液混合时酸的浓度大于碱的浓度,则二者体积关系不确定,大于、小于或等于都可能酸过量,故答案为:均有可能.
点评 本题考查较综合,涉及酸碱混合的定性分析、pH、电离与水解、电离方程式等,把握溶液中的溶质及电离与水解的趋势、相互影响即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢比硫化氢稳定 | |
| B. | 原子序数为 34 | |
| C. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| D. | Se 的非金属性比 Br 弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
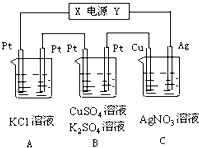 如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答:
如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰和碘分别变为气体 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②③④⑤ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
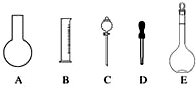 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com