
 下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:分析 (1)98%的浓H2SO4 0.5mL与3mL水混合后溶液的质量分数为$\frac{0.5mL×1.84g/ml×98%}{0.5mL×1.84g/mL+3g}$×100%=23%,60%以下的H2SO4氧化性较弱,不与铜反应;
(2)计算出加入再10mL浓硫酸后溶液中硫酸的质量分数,然后判断是否反应及反应现象;
(3)浓硫酸具有吸水性,将硫酸铜变成无水硫酸铜,据此判断反应现象;可以将冷却后的溶液加入盛有水的烧杯中观察;
(4)根据铜与浓硫酸反应可能生成黑色的Cu2S或硫化铜分析.
解答 解:(1)98%的浓H2SO4 0.5mL与3mL水混合后溶液的质量分数为:$\frac{0.5mL×1.84g/ml×98%}{0.5mL×1.84g/mL+3g}$×100%=23%,小于60%,60%以下的H2SO4氧化性较弱,与铜不反应,所以没有明显现象,
故答案为:无;H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象;
(2)甲同学再用分液漏斗加浓硫酸10mL,此时硫酸的质量分数为:$\frac{10.5mL×1.84g/mL×98%}{10.5mL×1.84g/mL+3g}$×100%=86.3%>60%,所以加热后浓硫酸与铜发生反应,现象为:铜片慢慢溶解,带支管的试管中溶液渐成蓝色,小试管中品红褪色,
故答案为:铜片慢慢溶解,带支管的试管中溶液渐成蓝色,小试管中品红褪色;
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应,由于原因是98%浓H2SO4有吸水性,生成无水CuSO4,则会观察到液体无色或浅蓝色,有白色固体在试管底部析出;为了最终看到与甲类似的现象,应该待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌,
故答案为:液体无色或浅蓝色,有白色固体在试管底部析出;98%浓H2SO4有吸水性,生成无水CuSO4;待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌;
(4)铜与浓硫酸反应可能生成Cu2S或硫化铜,所以黑色物质可能为Cu2S或硫化铜或Cu2S与硫化铜的混合物,
故答案为:Cu2S或硫化铜或Cu2S与硫化铜的混合物.
点评 本题考查了性质实验方案的设计,题目难度中等,明确题干信息及实验目的为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力,(1)为易错点,需要通过计算结果进行判断,注意掌握性质实验方案设计与评价原则.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:实验题
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)

序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究________________对化学反应速率的影响.
(2)分液漏斗中A溶液应该_____________加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是____________________.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X=____________
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是____________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:实验题
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
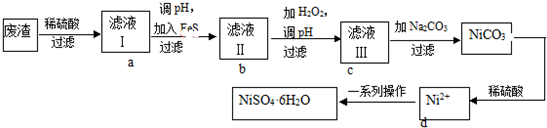
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
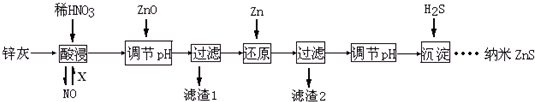
| A. | 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | 将酸浸的尾气循环利用,加入的X气体可以是O2 | |
| C. | 滤渣2中的成分和Zn和Fe | |
| D. | 当溶液中Zn2+浓度为小于1.0×10-5mol•L-1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 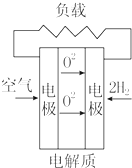 固体氧化物燃料电池 | B. | 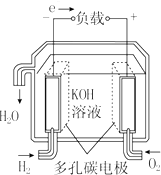 碱性燃料电池 | ||
| C. | 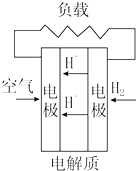 质子交换膜燃料电池 | D. | 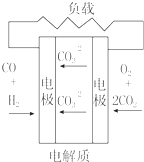 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com