
| A、用白醋清洗热水瓶中的水垢 |
| B、用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
| C、用铝锅长时间存放剩菜 |
| D、利用激光笔区别鸡蛋白溶液和浓盐水 |


科目:高中化学 来源: 题型:
| A、常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明(CH3COO)2Pb是弱电解质 |
| B、向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) |
| C、潜艇上的核反应堆使用液态铝-钠合金作载热介质,若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液 |
| D、向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-═I2+I- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),如配制100 mL这种H2SO4溶液,则需要18.4 mol?L-1的浓硫酸约为49.9mL |
| B、加入氧化剂H2O2后,只有Fe(OH)3沉淀出现,若溶液中c(Fe3+)=2.6×10-15mol?L-1,则溶液中c(Cu2+)≤2.2×10-4mol?L-1 |
| C、若加入NH4HCO3后生成的沉淀是Zn5(OH)6(CO3)2,则该反应为5ZnSO4+10NH4HCO3=Zn5(OH)6(CO3)2↓+5(NH4)2SO4+8CO2↑+2H2O |
| D、若生成的沉淀是形态均为Zna(OH)b (CO3)c的(a、b、c都是正整数)两种碱式碳酸锌的混合物,则分别可能是Zn5(OH)6(CO3)2 与Zn3(OH)6CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、适当摄入油脂,有助于人体吸收多种脂溶性维生素 |
| B、人体缺乏维生素D易引起夜盲症 |
| C、相对于各成分金属来说,合金的熔点更高,硬度更大 |
| D、柠檬酸在体内可以彻底氧化生成二氧化碳和水,所以柠檬是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、理论上任何放热的反应均能设计成为原电池 |
| B、实验室研究反应条件对速率的影响,硫代硫酸钠稀溶液与稀硫酸反应Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,常根据产生气泡的快慢判断反应速率的快慢 |
| C、恒温恒容,2molSO2(g)与1molO2(g)充分反应放出热量是aKJ,则该反应的热方程式是2SO2(g)+O2(g)?2SO3(g)△H=-akJ/mol |
| D、对于有气体参加的某放热反应,使用合适催化剂或增大压强(减小体积)均增加了单位体积内活化分子数目从而加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯是一种非常重要的非金属元素.
氯是一种非常重要的非金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④ |
| C、②③④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| C、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| D、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
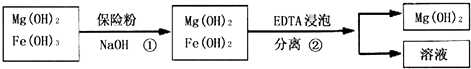
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com