
分析 (1)根据n=$\frac{m}{M}$计算出乙醇的物质的量,再计算出含有H原子数;乙醇分子中含有4个共价键,根据乙醇的物质的量计算出含有的共价键的物质的量;羟基中含有9个电子,结合乙醇的物质的量计算出该乙醇的羟基中含有的电子数;
(2)根据n=$\frac{m}{M}$计算出8g氧气的物质的量,最关键Vm=$\frac{V}{n}$计算出在该条件下的气体摩尔体积;
(3)根据n=cV计算出铝离子的物质的量,再根据硫酸铝的化学式计算出含有的硫酸根离子的物质的量;
(4)某二价金属的氯化物中含有0.2mol Cl-,该氯化物的物质的量为0.1mol,然后根据M=$\frac{m}{M}$计算出此氯化物的摩尔质量;
(5)根据n=$\frac{V}{{V}_{m}}$计算出标况下6.72L二氧化碳的物质的量,再根据电子守恒计算出生成铁的物质的量及质量、转移的电子数.
解答 解:(1)2.3g乙醇的物质的量为:$\frac{2.3g}{46g/mol}$=0.05mol,0.05mol乙醇分子中含义H原子的物质的量为:0.05mol×6=0.3mol,含义H原子数为0.3NA;
乙醇分子中含义5个C-H键、1个C-C键、1个C-O键和1个O-H键,总共含有8个共价键,则0.05mol乙醇分子中含义共价键的物质的量为:0.05mol×8=0.4mol;
0.05mol乙醇分子中含义0.05mol羟基,0.05mol羟基中含有的电子的物质的量为:9×0.05mol=0.45mol,含有电子数为0.45NA,
故答案为:0.3NA;0.4mol;0.45NA;
(2)8g氧气的物质的量为:$\frac{8g}{32g/mol}$=0.25mol,0.25mol氧气在该条件下的体积为6L,则该条件下的气体摩尔体积为:$\frac{6L}{0.05mol}$=24L/mol,
故答案为:24L/mol;
(3)100mL硫酸铝溶液中c(Al3+)=0.20mol/L,则该溶液中含有铝离子的物质的量为:n(Al3+)=0.20mol/L×0.1L=0.02mol,根据硫酸铝的化学式可知该溶液中含有的n(SO42-)=$\frac{3}{2}$n(Al3+)=0.03mol,
故答案为:0.03mol;
(4)9.5g某二价金属的氯化物中含有0.2mol Cl-,该氯化物的物质的量为:0.2mol$\frac{1}{2}$=0.1mol,则此氯化物的摩尔质量为:$\frac{9.5g}{0.1mol}$=95g/mol,
故答案为:95g/mol;
(5)标况下6.72L二氧化碳的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,0.3mol完全反应生成二氧化碳失去的电子的物质的量为:0.3mol×(4-2)=0.6mol,转移电子的数目为0.6NA,
根据电子守恒,反应生成铁的物质的量为:$\frac{0.6mol}{3-0}$=0.2mol,质量为:56g/mol×0.2mol=11.2g,
故答案为:11.2;0.6NA.
点评 本题考查了物质的量的计算,题目难度中等,试题知识点较多、计算量较大,充分考查学生的分析能力及化学计算能力,明确物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数等之间的关系为解答关键.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 加适量BaCl2溶液,过滤 | B. | 加适量澄清石灰水,过滤 | ||
| C. | 加热使Na2CO3和水反应 | D. | 加适量Ca(HCO3)2溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
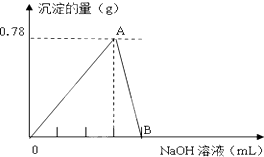 向20mLAlCl3溶液中滴入2mol•L-1NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mLAlCl3溶液中滴入2mol•L-1NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
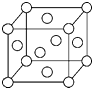 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质:冰醋酸、小苏打、明矾、氧化铝 | |
| B. | 化合物:液氯、干冰、烧碱、纯碱 | |
| C. | 混合物:漂白粉、铝热剂、矿泉水、磁性氧化铁 | |
| D. | 胶体:豆浆、墨水、血液、生理盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040mol•L-1,放出热量Q1kJ.
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040mol•L-1,放出热量Q1kJ.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com