
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 锡青铜的熔点比纯铜高 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
科目:高中化学 来源: 题型:实验题
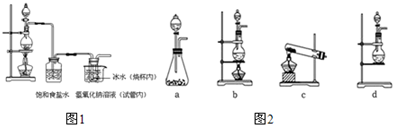
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol金属钠变为钠离子时失去的电子数为NA | |
| B. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA | |
| C. | 0.1mol/L的MgCl2溶液中,含有Mg2+数目为0.1NA | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 64g的S2和S8混合物中,含硫原子总数为2 NA | |
| C. | 1L 1mol/L氯化铁溶液中,含有NA个Fe3+ | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
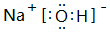 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
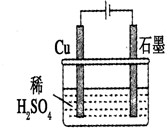
| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com