
科目:高中化学 来源: 题型:
下列实验现象及相关的离子方程式均正确的是( )
A.碳酸钙粉末中加入醋酸溶液,固体逐渐减少,生成无色气体:CaCO3+2H+===Ca2++CO2↑+H2O
B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O===BaSO3↓+2H+
C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2MnO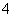 +7H2O2+6H+===2Mn2++6O2↑+10H2O
+7H2O2+6H+===2Mn2++6O2↑+10H2O
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀:Ba2++SO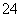 +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):
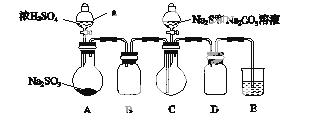
实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,
____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为 ( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液 ,某学生设计如下实验方案:
,某学生设计如下实验方案:
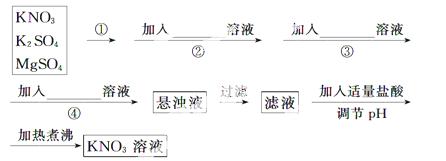
(1)操作①为____________________。
(2)操作②~④加入的试剂依次可以为____________________________________。
(3)如何判断SO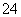 已除尽?_____________________________________________。
已除尽?_____________________________________________。
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,其理由是
_____________ ____________________________________________
____________________________________________ _______________。
_______________。
(5)该同学的实验设计方案是否严密?请说明理由:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下实验能获得成功的是
A.用乙醇和乙酸混合共热制取乙酸乙酯
B.将铁屑、溴水、苯混合制溴苯
C.在苯中滴入浓硝酸制硝基苯
D.将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
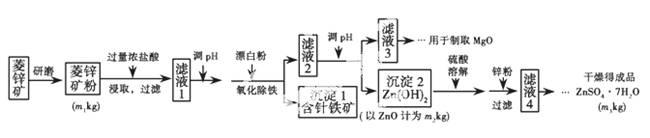
(1)将菱锌矿研磨成粉的目_________。
(2)完成“氧化除铁”步骤中反应的离子方程式:

(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是____________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________________。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性 质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
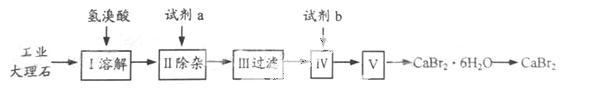
完成下列填空:
35.上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
36.已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
37.试剂b是 ,步骤Ⅳ的目的是 。
38.步骤Ⅴ所含的操作依次是 、 。
39.制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对分子、原子、离子的认识,其中正确的是( )
A、氢原子是最小的微粒,不可再分
B、镁原子的质子数大于镁离子的质子数
C、当液态水变成冰,水分子间不存在间隔
D、分子、原子、离子都可以直接构成物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com