
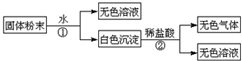
| 序号 | 化学式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
分析 固体粉溶于水得到无色溶液和白色沉淀,则一定不含有CuSO4,难溶物溶于稀盐酸得到气体和溶液,说明一定含有CaCO3,Na2SO4和Ba(NO3)2不会同时存在,可能存在KCl,以此解答该题.
解答 解:固体粉溶于水得到无色溶液和白色沉淀,则一定不含有CuSO4,难溶物溶于稀盐酸得到气体和溶液,说明一定含有CaCO3,Na2SO4和Ba(NO3)2不会同时存在,可能存在KCl,
(1)实验涉及的反应为碳酸钙和盐酸的反应,离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(2))取样品加水,得到无色溶液,该固体粉末中一定不含有CuSO4,因为CuSO4溶于水,显蓝色,取样品加水,出现白色沉淀,该固体粉末中一定含有CaCO3,只有CaCO3是沉淀,难溶于水,故答案为:CuSO4;CaCO3;
(3)固体粉末中一定不存在的物质是硫酸铜,一定存在的物质是碳酸钙,Na2SO4和Ba(NO3)2不会同时存在,可能存在KCl,这三种物质的组合可以是:CaCO3、Na2SO4、KCl或者是CaCO3、Ba(NO3)2、KCl,故答案为:
| 序号 | 化学式 |
| Ⅰ | CaCO3、Na2SO4、KCl |
| Ⅱ | CaCO3、Ba(NO3)2、KCl |
| Ⅲ |
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,解答本题要从物质的颜色、物质之间相互作用时的实验现象等方面进行分析、判断,从而得出正确的结论,难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.现用该浓硫酸配制980mL 0.1mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.现用该浓硫酸配制980mL 0.1mol/L的稀硫酸.可供选用的仪器有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A元素与C元素形成的分子不可能是非极性分子 | |
| B. | A、C、D元素分别与氢元素形成的最简单氢化物中,D的氢化物沸点最高 | |
| C. | A、B、C、D四种元素的基态原子中,B的原子半径最大 | |
| D. | A、B、C、D 四种元素对应单质的晶体都是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两份均为18g的Al片分别与足量的盐酸和NaOH溶液充分转移电子总数均为2NA | |
| B. | 1 molCu和2 mol热浓硫酸充分反应,可生成NA个SO2分子 | |
| C. | 标准状况下,14g N2和C2H4混合气体的体积为11.2L | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | l L pH=l的硫酸溶液中含有的H+ 数为0.2NA | |
| C. | 78 g Na202固体中含有的阴离子数为2NA | |
| D. | 500 mL 2 mol.L-l FeCl2溶液中Fe3+数为NA,且$\frac{n(C{l}^{-})}{n(F{e}^{3+})}$=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7的溶液中:Na+、Mg2+、S042-、I- | |
| B. | 使甲基橙试液变红的溶液中:Al3+、Cu2+、N03-、SO42- | |
| C. | 由水电离出的c(H+)=l.0×10-13mol•L-1的溶液中:Na+、C032-、SO32-、Cl一 | |
| D. | 加铝粉能产生大量H2的溶液中:Na+、NH4+、N03-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
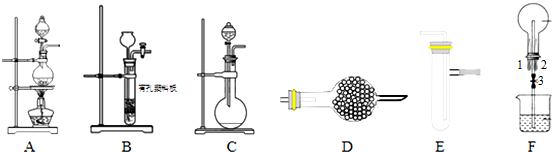
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 操作 | 从CCl4萃取溴水中溴后的混合液中分离 | 二氧化锰与浓盐酸反应制干燥氯气 | 可用于制备并观察氢氧化铁沉淀 | 检查装置气密性 |
| 实验装置 | 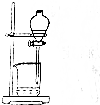 | 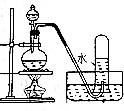 | 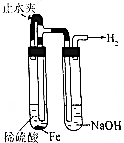 | 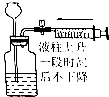 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com