
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为__________。
(2) CH3COOH中碳原子的杂化形式为________。
(3) NO3-的空间构型是①______,与NO3-互为等电子体的分子的化学式为②______(任写一种)。
(4) CH3COOH能与H2O以任意比互溶的原因是____________________。
(5)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为①_______,晶体中每个镁原子周围距离最近的铝原子数目为②_______,该晶体的密度为③______g/cm3(阿伏伽德罗常数的数值用NA表示)。
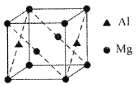
【答案】3d54s2 sp3和sp2 平面三角形 BF3或BCl3 CH3COOH与H2O均为极性分子,且分子间可以形成氢键 Mg2Al 4 ![]()
【解析】
(1)锰为25号元素,基态锰原子的价层电子为其3d、4s能级上的电子;
(2)CH3COOH中甲基上C原子价层电子对个数是4、羧基上C原子价层电子对个数是3,根据价层电子对互斥理论判断碳原子的杂化形式;
(3)根据价层电子对个数=σ键个数+孤电子对个数,判断NO3-离子的空间构型,与NO3-互为等电子体的分子中含有4个原子、价电子数是24;
(4)极性分子的溶质易溶于极性分子的溶剂,能和水分子形成分子间氢键的物质易溶于水;
(5)根据均摊法计算晶胞中含有的Al原子和Mg原子个数,确定晶胞的化学式;根据晶胞结构判断晶体中每个镁原子周围距离最近的铝原子数目;根据晶体的密度=![]() 计算。
计算。
(1)锰为25号元素,价层电子为其3d、4s能级上的电子,基态锰原子的价层电子排布式为3d54s2 ,故答案为:3d54s2;
(2) CH3COOH中甲基上的碳原子含有4个σ键,没有孤电子对,采用sp3杂化,羧基上的碳原子含有3个σ键,没有孤电子对,采用sp2杂化,故答案为:sp3和sp2;
(3) NO3一中氮原子价层电子对数为3+![]() =3,N原子轨道的杂化类型为sp2,空间构型为平面三角形;NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3、BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;SO3或BF3、BCl3等;
=3,N原子轨道的杂化类型为sp2,空间构型为平面三角形;NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3、BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;SO3或BF3、BCl3等;
(4) CH3COOH与H2O均为极性分子,且分子间可以形成氢键,使得CH3COOH能与H2O以任意比互溶,故答案为:CH3COOH与H2O均为极性分子,且分子间可以形成氢键;
(5)该晶胞中含有Al原子个数=2×![]() =1、Mg原子个数=2×
=1、Mg原子个数=2×![]() +8×
+8×![]() =2,所以其化学式Mg2Al;在晶胞中,镁原子位于顶点和2个面的面心,铝原子位于2个面的面心,每个镁原子周围距离最近的铝原子数目为4个,距离均为面对角线长度的一半;晶胞棱长为anm,则晶胞体积=(a×10-7)3cm3,晶胞的质量=
=2,所以其化学式Mg2Al;在晶胞中,镁原子位于顶点和2个面的面心,铝原子位于2个面的面心,每个镁原子周围距离最近的铝原子数目为4个,距离均为面对角线长度的一半;晶胞棱长为anm,则晶胞体积=(a×10-7)3cm3,晶胞的质量=![]() g=
g=![]() g,则晶胞的密度=
g,则晶胞的密度=![]() =
= =
=![]() g/cm3,故答案为:Mg2Al;4;
g/cm3,故答案为:Mg2Al;4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
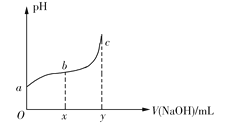
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO3(g)![]() 2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
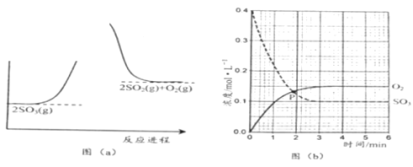
A.由图(a) 知,正反应为放热反应
B.图(b)中,SO3分解的平均速率0~1min比1~2min慢
C.图(b)中,P点时反应达到平衡状态
D.由图(b)知,SO2的平衡浓度为0.3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),达到平衡时,生成了2mol C,经测定,D的浓度为0.5mol·L-1,下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年获诺贝尔化学奖的是约翰·班尼斯特·古迪纳夫(John B.Goodenough)、迈克尔·斯坦利·威廷汉(M.Stanley Whittlingham)和吉野彰( Akira Yoshino)三位科学家,他们在锂离子电池发展上做出了突出贡献。锂离子电池是将层状石墨加导电剂及黏合剂涂在铜箔基带上,将钴酸锂(LiCoO2)涂在铝箔上制作而成,利用锂离子在两极上的嵌入和脱嵌进行充、放电,其原理如图所示。下列说法错误的是

LiCoO2+6C=Li1-xCoO2+LixC6
A.石墨加导电剂及黏合剂涂在铜箔基带上作锂离子电池的负极
B.充电时Li+从石墨层状结构中脱嵌,进入电解质
C.放电时的正极反应为Li1-xCoO2+xLi++xe-=LiCoO2
D.锂离子电池常用非水液态有机电解质作电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃)。在有机合成中被称为“万能还原剂”。湿法制备硼氢化钠的流程如下:
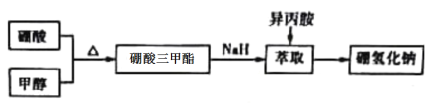
请回答有关问题。
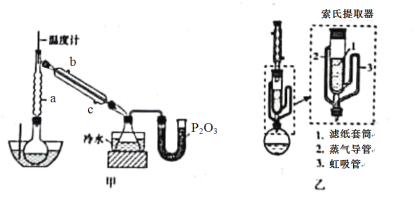
Ⅰ.硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图甲所示(夹持装置略去,下同)。
已知,相关物质的性质如下表。
硼酸三甲脂 | 甲醇 | 甲醇钠 | |
溶解性 | 与乙醇、甲醇混溶,能水解 | 与水混溶 | 溶于甲醇,不溶于异丙胺 |
沸点/℃ | 68 | 64 | 450 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | |||
(1)图甲中分馏柱a的作用是___________;直形冷凝管冷却水应从___________(填“b”或“c”)接口进入。
(2)圆底烧瓶中发生的主要反应的化学方程式为________________________。
(3)本实验采用水浴加热,优点是___________________;U型管中P2O3的作用是_________________。
Ⅱ.“萃取”时,可采用索氏提取法,其装置如图乙所示。实验时烧瓶中溶剂受热蒸发,蒸气沿蒸气导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。
(4)萃取完全后,硼氢化钠位于______________(填“圆底烧瓶”或“索氏提取器”)中。
(5)与常规的萃取相比,采用索氏提取法的优点是______________。
Ⅲ.某同学欲通过测定硼氢化钠与水反应生成氢气的体积来测定硼氛化钠产品的纯度(杂质与水不反应)。
(6)硼氢化钠与水反应生成氢气和偏硼酸钠,该反应的化学方程式为______________。
(7)该同学称取0.7 g样品,测得生成气体的体积为1.4 L(已折算为标准状况),则样品中硼氢化钠的纯度为________%(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取乙酸乙酯

(1)在大试管中加入碎瓷片然后配制一定比例的乙醇、乙酸和浓硫酸的混合液,然后轻轻振荡试管使之混合均匀,加入碎瓷片的目的的________。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是____________。
(3)图中右边试管中试剂是_________________。作用是①__________________②_______________________________③____________________________。
(4)分离得到乙酸乙酯的方法是____________,分离需要的玻璃仪器是______________________。
(5)写出制乙酸乙酯的方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在家期间设计了如下实验验证家中常见的两种有机物性质,请根据题目要求填写下列空格:
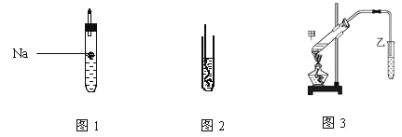
(1)如图1所示,试管中装乙醇产生反应的方程式_____ ,该反应类型为____ ;
(2)如图2所示,螺旋状的铜丝加热后可以铜丝表面变成______色,插入到装有乙醇的试管中铜丝表面又变成___色,并闻到有刺激性气味,该物质的结构简式为__;
(3)将鸡蛋放入食醋中看到鸡蛋表面有气泡生成,说明醋酸的酸性_____碳酸的酸性。(填“强于”或“弱于”)
(4)按如图3所示装置,甲试管中装有乙酸、乙醇、浓硫酸还需要加入____,目的是_______;加热时发生的反应方程式为__________,一段时间后在装有饱和碳酸钠溶液的乙试管______(填“上方”或“下方”)可以看到油状物质并闻到有特殊香味,分离该物质的实验操作是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com