
【题目】现有常温下的四种溶液(如下表),下列有关叙述正确的是( )
① | ② | ③ | ④ | |
氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
pH | 11 | 11 | 3 | 3 |
A.分别加水稀释10倍,四种溶液的pH为:①>②>③>④
B.温度上升10℃,四种溶液的pH不变
C.③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变
D.将①④两种溶液等体积混合,所得溶液中c (C1-) >c NH4+)>c (H+)>c (OH- )
【答案】A
【解析】
试题分析:A、①氨水pH=11,平衡状态下氢氧根离子浓度为10-3mol/L;②氢氧化钠pH=11,氢氧根离子浓度为10-3mol/L;③醋酸pH=3,平衡状态下氢离子浓度为10-3mol/L;④盐酸pH=3,溶液中氢离子浓度为10-3mol/L;分别加水稀释10倍,碱比酸的pH大,弱碱弱酸存在电离平衡,加水稀释比强酸强碱的pH变化小,所以得到四种溶液的pH大小为①>②>④>③,故A正确;B、升高温度,水的离子积增大,弱电解质的电离程度增大,所以氨水中氢氧根离子浓度增大,溶液pH增大;氢氧化钠溶液中氢氧根离子浓度不变,水的离子积增大,溶液中氢离子浓度增大,溶液pH减小;醋酸溶液中,醋酸的电离程度增大,溶液中氢离子浓度增大,溶液的pH减小;盐酸溶液中氢离子浓度基本不变,溶液的pH不变,故B错误;C、在③④中分别加入适量的醋酸铵晶体后,③中溶解形成的醋酸根离子对醋酸弱电解质的电离平衡起到了抑制作用,氢离子浓度减小,pH增大;④中溶解的醋酸根离子与氢离子会结合成弱电解质醋酸,减小了氢离子的浓度,pH增大,故C错误;D、将①氨水PH=11,平衡状态下氢氧根离子浓度为10-3mol/L④盐酸PH=3,溶液中氢离子浓度为10-3mol/L两种溶液等体积混合,氨水中平衡状态下的氢氧根离子与盐酸中的氢离子恰好反应,氨水又电离出氢氧根离子和铵根离子,依据电离方程式NH3H2O![]() NH4++OH-;HCl=H++Cl-,可知c(Cl-)=5×10-4mol/L,c(NH4+)>5×10-4mol/L,c(OH-)>c(H+),综上所述可知溶液中的离子浓度大小c(NH+4)>c(Cl-)>c(OH-)>c(H+),故D错误;故选A。
NH4++OH-;HCl=H++Cl-,可知c(Cl-)=5×10-4mol/L,c(NH4+)>5×10-4mol/L,c(OH-)>c(H+),综上所述可知溶液中的离子浓度大小c(NH+4)>c(Cl-)>c(OH-)>c(H+),故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】只能表示一个化学反应的离子方程式是
A.OH-+H+=H2O
B.CO32-+2H+=H2O+CO2↑
C.Mg(OH)2+2H+=Mg2++2H2O
D.Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列有关说法中正确的是( )
A. 先生成沉淀,后沉淀全部溶解
B. 当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大
C. 最后得到的沉淀是BaSO4
D. 最后的沉淀为2 mol BaSO4、1 mol Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3、K2SO4和明矾的混合液中,如果SO42-的物质的量浓度为0.2 mol·L-1,当加入等体积的0.2 mol·L-1的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A. 0.2 mol·L-1 B. 0.25 mol·L-1
C. 0.225mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨气的说法正确的是
A. 氨既能用浓硫酸干燥也能用无水CaCl2干燥
B. NH3是电解质,所以氨水能导电
C. NH3可以使干燥的红色石蕊试纸变蓝
D. 用水吸收NH3用如图装置可防止倒吸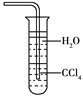
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A. 0.05 mol B. 1 mol C. 1.05 mol D. 0.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 原子最外层电子数为2的元素一定处于周期表ⅡA族
B. 主族元素的最高化合价与最低化合价的绝对值之和为8
C. K与水反应比Li与水反应剧烈
D. Li+和H-的离子半径相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如下图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如下图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、 ΔH<0
2CO(g)的 ΔS>0、 ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ) <2p总(状态Ⅰ)
C. 体系中 c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆: v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com