
����Ŀ���л���A���������Ƿ��͵õ���Ҳ���Դ�ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
��ȡA9.0g������ʹ�������������ܶ�����ͬ������H2��45�� | ��ͨ��������գ� ��1��A����Է�������Ϊ__�� |
��9.0gA��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g | ��2��A�ķ���ʽΪ__�� |
��ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2����״�������������������Ʒ�Ӧ������2.24LH2����״������ | ��3���ýṹ��ʽ��ʾA�к��еĹ�����__��__�� |
A�ĺ˴Ź���������ͼ��
| ��4��A�к���__����ԭ�ӡ� ����������A�Ľṹ��ʽΪ__�� |
���𰸡�90 C3H6O3 -COOH -OH 4 ![]()
��������
��1����ͬ�����£��������Է�������֮�ȵ����ܶ�֮�ȣ�
��2��Ũ�����������ˮ����ʯ�ҿ������ն�����̼������Ԫ���غ���ȷ���л���ķ���ʽ��
��3���Ȼ����Ժ�̼�����Ʒ�����ѧ��Ӧ���ɶ�����̼��-OH��-COOH�ͽ����Ʒ�����ѧ��Ӧ�������������������������ʵ����жϺ��еĹ����ţ�
��4���˴Ź�������ͼ���м�����ֵ���м������͵ĵ�Ч��ԭ�ӣ������֮�ȵ�����ԭ�ӵ���Ŀ֮�ȣ�
��5�����A�ķ���ʽ�����еĹ�����ȷ��A�Ľṹ��ʽ��
(1)�����ܶ�����ͬ������H2��45������֪A����Է�������Ϊ45��2=90��
�ʴ�Ϊ��90��
(2)���������֪��n(A)=9.0g��90g/mol=0.1mol��n(C)=n(CO2)=13.2g��44g/mol=0.3mol��n(H)=2n(H2O)=2��5.4g��18g/mol=0.6mol��n(O)=��9g0.3��12g0.6��1g����16g/mol=0.3mol�����Ը���ԭ���غ��֪A�ķ���ʽΪC3H6O3��
�ʴ�Ϊ��C3H6O3��
(3)0.1molA��NaHCO3��Ӧ�ų�0.1molCO2����˵A��Ӧ����һ���Ȼ����������������Ʒ�Ӧ������0.1molH2��˵��A�л�����һ���ǻ���
�ʴ�Ϊ��-COOH��-OH��
(4)�˴Ź�����������4�����շ壬���֮��Ϊ1:1:1:3����֪A��Ӧ����4�ֲ�ͬ��������ԭ�ӣ����ݺ˴Ź�������ͼ�����л�������4����ֵ����4�����͵ĵ�Ч��ԭ�ӣ�����ԭ�ӵĸ�������3:1:1:1�����Խṹ��ʽΪ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ�����±���ʾʵ�飬ʵ������ͽ��۾���ȷ����
ѡ�� | ʵ����� | ���� | ���� |
A | ��������״̬��NaHSO4�ĵ����� | �ܵ��� | ����״̬��NaHSO4�ܵ����Na+��H+�� |
B | պ��Ũ��ˮ�IJ���������X | �а��̲��� | X����ΪŨ���� |
C | �������������������1:4������Թ��й��� | ��Ӧ����������ʹ��ʪ��ʯ����ֽ��� | ���ɵ��ȴ������������ |
D | ��AlCl3��Һ�������� | �õ���ɫ���� | ��ɫ����ɷ�Ϊ������AlCl3 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������һƿ��84����Һ������װ˵�����£�

����������Ϣ�����֪ʶ�жϣ����з�������ȷ����
A.�á�84����Һ�������ʵ���Ũ��ԼΪ4.0mol��L-1
B.һƿ�á�84����Һ�������տ�����44.8L��CO2(��״��)����ȫ����
C.ȡ100mL�á�84����Һ��ϡ��100��������������ϡ�ͺ����Һ��c(Na��)ԼΪ0.04mol��L-1
D.���ĸá�84����Һ�����䷽������NaClO��������480mL��25% NaClO������Һ����Ҫ������NaClO��������Ϊ149g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧͨ��ʵ���о�Na2O2��ˮ�ķ�Ӧ��
���� | ���� |
��ʢ������Na2O2���Թ��м�������ˮ���õ���Һa | ��Ӧ���ң�������ʹ������ľ����ȼ������ |
Ȼ������Һa�е������η�̪ | ��Һ�ȱ�죬����dz��Լ10������Һ��Ϊ��ɫ |
Ϊ��̽����Һ��Ϊ��ɫ��ԭ��ͬѧ���տ�ѧ�ij�����������ʵ�飺
����������裩
Na2O2��H2O��Ӧ�Ļ�ѧ����ʽ_____������Һa�еμӷ�̪��Ӧֻ���죬��ʵ���з��ַ�̪��������ɫ���ɴ�������µļ��裺
����A��O2��Ư���� ����B��NaOH��Ư���� ����C��O2��NaOH��ͬ������Ư����
��ʵ����۲죩
��2��������±���
ʵ���� | 1 | 2 | 3 |
ʵ��װ�� |
|
|
|
ʵ����� ���A������B����C���� | ����_____ | ����____ | ����__ |
ʵ������ | ��Һ����10���Ӿ��ޱ仯 | ||
ʵ����� | _____ | ||
���������ϣ�
��ͬѧ�������ϣ�H2O2��һ���ڼ��������²��ȶ�������Ư���Ե����ʡ�
����������裩
��ͬѧ��Ϊ��ɫ��ԭ���������Һa�д���H2O2��H2O2Ư���˷�̪��
��ʵ����۲죩
��3��ͨ��ʵ��֤ʵ��H2O2�Ĵ��ڣ�ȡ������Һa�������ɫ��ĩ____���ѧʽ�������ٲ�������ʹ������ľ����ȼ�����塣��ͬѧ��һ��ͨ��ʵ��֤ʵ����Һa�е����̪��H2O2���̪�����˻�ѧ��Ӧ��ʵ�鷽����ȡ������Һa���Թ��У�_____��
����������ۣ�
��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨij�л���A�Ľṹ��������ʵ�飺

����4.4g���л�����ȫȼ�գ����� 0.2mol CO2��3.6gˮ��
���������Dzⶨ����Է�������������ͼ1��ʾ������ͼ��
��A�ĺ˴Ź���������ͼ2��
�Իش��������⣺
��1���л���A����Է���������_____________
��2���л���A��ʵ��ʽ��_____________
��3���л���A�ķ���ʽ��_____________
��4����������Ϸ���A�Щ�COOH��2����CH3���л���A�Ľṹ��ʽ ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SO2�����̿�(��Ҫ�ɷ�ΪMnO2������Fe��Al��Ca��Pb�Ļ������)����ˮ����������Ϊԭ�Ͽ��Ʊ�MnSO4Һ��Mn3O4����Ҫʵ�鲽������
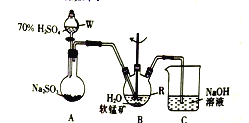
����I����ͼ��ʾװ�ã���SO2ͨ��B�е����̿�Һ��(MnO2+SO2=MnSO4)��
����II����ַ�Ӧ���ڲ��Ͻ���������������R�м�������������MnO2��MnCO3������������Na2S��Ǧ��
����III�����˵�MnSO4��Һ
(1)����R��������_______��
(2)װ��A������ȡSO2����Ӧ�Ļ�ѧ����ʽΪ_________��
(3)װ��B�еķ�ӦӦ������90~100�������˵ļ��ȷ�ʽ��______________��
(4)װ��C��������______________________��
(5)���������м��봿��MnO2��Ŀ����_______________����MnCO3������ҺpHʱ���������ҺpH�ķ�ΧΪ________(��ʵ�������£����ֽ������ӿ�ʼ�����ͳ�����ȫ��pH���±�)
�������� | Fe2+ | Fe3+ | Al3+ | Mn2+ |
��ʼ������pH | 7.04 | 1.87 | 3.32 | 7.56 |
������ȫ��pH | 9.18 | 3.27 | 4.9 | 10.2 |
(6)��֪���ÿ�������Mn(OH)2��Һ���Ʊ�Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O]����Ҫ������ΪMnOOH����Ӧ�¶Ⱥ���ҺpH�Բ�Ʒ��Mn������������Ӱ��ֱ���ͼ��ʾ
2Mn3O4+6H2O]����Ҫ������ΪMnOOH����Ӧ�¶Ⱥ���ҺpH�Բ�Ʒ��Mn������������Ӱ��ֱ���ͼ��ʾ

�ڷ�Ӧ�¶ȳ���80��ʱ��Mn3O4�IJ��ʿ�ʼ���ͣ�Mn(OH)2�ǰ�ɫ������Mn3O4�ʺ�ɫ��Mn3O4��MnOOH���̵�������������ֵ����Ϊ72.05����62.5%�벹�������ɲ���III�õ�MnSO4��Һ�����ð�ˮ���Ʊ��ϴ�����Mn3O4��ʵ�鷽����______________________����ո���6Сʱ�ò�ƷMn3O4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Դ���⣬��ˮ��Դ�Ŀ������������ִ���δ����������⡣�����Ǻ�ˮ���õ�����ͼ��
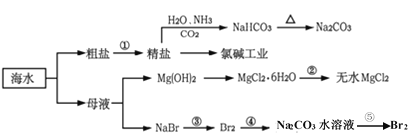
�����й�˵������ȷ����
A.�������Ƶ�NaHCO3������������Һ��ͨ��CO2����ͨ��NH3
B.�ȼҵ������������ʹʪ����۵⻯����ֽ����������
C.��Ӧ�ڼ���MgCl2��6H2OӦ��HCl�����������Ʊ���ˮMgCl2
D.��Ӧ���У���Na2CO3ˮ��Һ����Br2����70��80%���ḻ��Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������¼����л��
��![]() ��
��![]() ��
��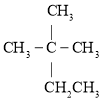 ��
��![]() ��
��![]()
��![]() ��
��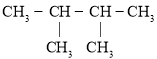 ��
��![]() ��
��![]()
�������������������ʰ�Ҫ��ش��������⣺
��1���۵�ϵͳ������________��
��2������������ʾ�٢ۢܢ��۷е�ߵ�˳��________������ţ���
��3����ۻ�Ϊͬϵ�����________������ţ���
��4�����һ�ȴ���ͬ���칹����Ŀ��________�֡�
��5����120�棬![]() �����£�ij����̬����������
�����£�ij����̬����������![]() ��ȫ��Ӧ��÷�Ӧǰ����������û�з����ı䣬�������________������ţ���
��ȫ��Ӧ��÷�Ӧǰ����������û�з����ı䣬�������________������ţ���
��6��д������������������������Һ�巢��ȡ����Ӧ�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���ɶ���������Ԫ����ɵĻ�����(��ͼ��ʾ)���������õĴ������ܣ�����Ԫ��W��X��Y��Z��ԭ�����������������ܺ�Ϊ24�������й������������
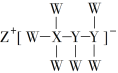
A.�û������У�W��X��Y֮���Ϊ���ۼ�
B.Z�ĵ��ʼ�����ˮ��Ӧ��Ҳ����״���Ӧ
C.Y������ϼ��������ˮ����Ϊǿ��
D.X�ķ�����XF3��ԭ�Ӿ�Ϊ8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com