
【题目】某有机物(分子式为C13H18O2)是一种食品香料,其合成路线如下图所示。

通过质谱法测得A的相对分子质量为56,它的核磁共振氢谱显示有两组峰且峰面积之比为1∶3;D分子中含有支链;F分子中含有苯环但无甲基,E可发生银镜反应,在催化剂存在下1molE与2 molH2可以发生反应生成F。请回答:
(1)A的化学名称为__________ ,B中所含官能团的名称为________,E的结构简式为________。
(2)C与新制Cu(OH)2悬浊液反应的离子方程式为________________________________。
(3)D与F反应的化学方程式为_______________________;其反应类型是_____________。
(4)写出符合下列条件的F的同分异构体_______________________________(写出其中的一种即可,F除外)
①遇FeCl3溶液显紫色;②核磁共振氢谱有四种不同化学环境的氢,且峰面积比为1:2:3:6。
(5)苯乙酸乙酯(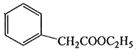 )是一种重要的医药中间体。写出以苯乙酮(
)是一种重要的医药中间体。写出以苯乙酮(![]() )和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选)。
)和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选)。
合成路线流程图请参考如下形式:
![]() __________________________________________________
__________________________________________________
【答案】 2-甲基丙烯 羟基 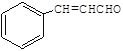
![]() + 2Cu(OH)2
+ 2Cu(OH)2![]()
![]() H+ Cu2O↓ +2H2O
H+ Cu2O↓ +2H2O ![]() +
+![]()
![]()
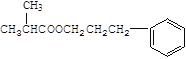 + H2O 取代(酯化)
+ H2O 取代(酯化) 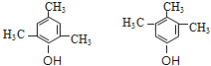
【解析】有机物A属于烃类,其相对分子质量为56,则![]() =4…8,可知A的分子式为C4H8,A发生信息中的反应生成B,B可以连续发生氧化反应,A的核磁共振氢谱有2组峰且峰面积之比为1:3,则A为(CH3)2C=CH2,B的结构简式为(CH3)2CHCH2OH,C的结构简式为(CH3)2CHCHO,D的结构简式为(CH3)2CHCOOH,D和F反应生成有机物C13H18O2,应是发生酯化反应,则F为醇,D中含有4个碳原子,所以F中含有9个碳原子,F的分子式为C9H12O,E可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol E与2mol H2反应可以生成F,F分子中含有苯环但无甲基,可推知E为
=4…8,可知A的分子式为C4H8,A发生信息中的反应生成B,B可以连续发生氧化反应,A的核磁共振氢谱有2组峰且峰面积之比为1:3,则A为(CH3)2C=CH2,B的结构简式为(CH3)2CHCH2OH,C的结构简式为(CH3)2CHCHO,D的结构简式为(CH3)2CHCOOH,D和F反应生成有机物C13H18O2,应是发生酯化反应,则F为醇,D中含有4个碳原子,所以F中含有9个碳原子,F的分子式为C9H12O,E可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol E与2mol H2反应可以生成F,F分子中含有苯环但无甲基,可推知E为![]() ,F为
,F为![]() ,则G为
,则G为![]() .
.
(1)A为(CH3)2C=CH2,其化学名称为2-甲基丙烯;B为(CH3)2CHCH2OH,含有的官能团为羟基;E的结构简式为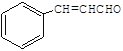 ;
;
(2)C为(CH3)2CHCHO,与新制Cu(OH)2悬浊液反应的化学方程式为:(CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O↓+3H2O;
(CH3)2CHCOONa+Cu2O↓+3H2O;
(3)D+F→G的化学方程式: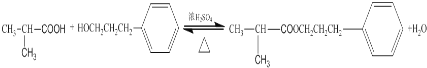 ,属于取代反应;
,属于取代反应;
(4)F(![]() )的同分异构体满足:①遇FeCl3溶液显紫色,说明含有酚羟基;②核磁共振氢谱有四种不同化学环境的氢,且峰面积比为1:2:3:6,符合条件的同分异构体为:
)的同分异构体满足:①遇FeCl3溶液显紫色,说明含有酚羟基;②核磁共振氢谱有四种不同化学环境的氢,且峰面积比为1:2:3:6,符合条件的同分异构体为: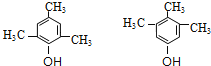 ;
;
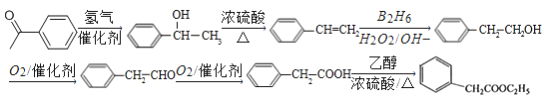
(5)![]() 发生加成反应生成
发生加成反应生成![]() ,再发生消去反应生成
,再发生消去反应生成![]() ,经过B2H6、H2O2/OH-得到
,经过B2H6、H2O2/OH-得到![]() ,氧化生成苯乙醛,进一步氧化生成苯乙酸,再与乙醇发生酯化反应生成苯乙酸乙酯,合成路线流程图为:
,氧化生成苯乙醛,进一步氧化生成苯乙酸,再与乙醇发生酯化反应生成苯乙酸乙酯,合成路线流程图为: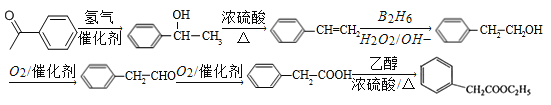 。
。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃,SOCl2中氧元素与硫元素直接以共价键相连,其中C1呈-1价, SOCl2遇水即剧烈反应,液面上有酸雾形成,并有带刺激性气味的气体逸出。该气体可使品红溶液褪色,加热后颜色恢复。请回答下列问题:
I.蒸干MgCl2溶液不能得到无水MgCl2,若将SOC12与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOC12与水反应的方程式和必要的文字描述原因____________。
II. 向1 L 0.1 mol·L-1的Ba(OH)3溶液中滴入SOCl2开始时产生白色沉淀,继续加入SOCl2至过量发现白色沉淀逐渐溶解。
(1)出现白色沆淀的离子方程式为__________________。
(2)白色沉淀溶解过程中发生反应:BaSO3+ H+==Ba2++HSO3-;当沉淀完全溶解时测得溶液的pH=3,忽略滴入SOCl2的体积,则溶液中的c(HSO3-)=_______。(H2SO4: Ka1=1.5×10-5,Ka2=1.0×10-7,BaSO3:Kap=5.0×10-7)
III.工业上,氧化亚砜可由如下反应制得:
i.SO3(g)+SCl2(g) ![]() SOCl2(g)+SO2(g) △H1=+302 kJ·mol-1
SOCl2(g)+SO2(g) △H1=+302 kJ·mol-1
ii.SO2(g)+PCl5(g) ![]() SOCl2(g)+POCl3(g) △H2=-268kJ·mol-1
SOCl2(g)+POCl3(g) △H2=-268kJ·mol-1
(1)已知各分子中化学键的键能如下表所示:

则表中x=________________。
(2)向1 L容积恒定的密闭容器中充入1.0molPCl5(g)、1.0mol SO3(g)和1.0 mol SCl2(g),进行上述两个反应,其他条件不变时,体系内SO2的平衡体积分数与温度(T)的关系如图所示。

①随着温度的升高,SO2的平衡体积分数增大的原因为_________。
②T1℃时,测得平衡体系中SO3的物质的量为0.2 mol。则该温度下,PCl5的平衡转化率为______,反应I的平衡常数的值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A. 常温下所有的金属都是固态 B. 金属具有导电、导热和延展性
C. 地壳中含量最多的金属铁元素 D. 金属元素大多数以游离态存在于自然界
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氢氧化铁胶体的说法不正确的是:
A. 往NaOH饱和溶液中滴加FeCl3饱和溶液,加热煮沸制备氢氧化铁胶体
B. 氢氧化铁胶体的胶粒大小在1-100nm之间
C. 氢氧化铁胶体可发生丁达尔效应
D. 往氢氧化铁胶体中滴加电解质溶液可发生聚沉现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国庆期间,我市著名景点芙蓉洞每天接待游客上万,其中美不胜收的石笋、石钟乳和石柱等均为石灰石,石灰石的主要成分是:
A. Ca(OH)2 B. CaCO3 C. CaO D. CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需2mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3·10H2O 的质量分别是()
A. 1000mL,212g B. 950mL,543.4g C. 950mL,201.4g D. 1000mL,572g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】记住酸碱盐的溶解性对书写离子方程式很有帮助。下列物质中难溶于水的是:
A. FeSO4 B. CaCl2 C. H2SiO3 D. NaClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+的物质的量浓度为0.5 molL1的某澄清溶液中,还可能含有如下离子:K+、Mg2+、Ba2+、![]() 、
、![]() 、
、![]() 。取100 mL该溶液进行如下实验(气体体积在标准状况下测定):
。取100 mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33 g;
下列说法正确的是
A.一定不存在的离子是Mg2+、Ba2+,不能确定是否含有K+、![]()
B.一定存在的离子是![]() 、
、![]() ,
,![]() 的物质的量浓度为0.25 molL1,
的物质的量浓度为0.25 molL1,![]() 的物质的量浓度为0.1 molL1
的物质的量浓度为0.1 molL1
C.一定存在的离子是![]() 、
、![]() 、K+,其中K+浓度≥0.2 molL1
、K+,其中K+浓度≥0.2 molL1
D.一定存在的离子是![]() 、
、![]() 、K+,其中K+浓度为0.2 molL1
、K+,其中K+浓度为0.2 molL1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com