
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
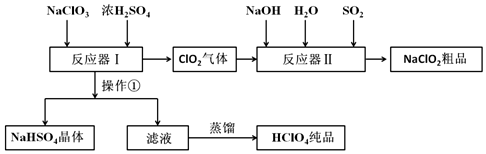
分析 NaClO3和浓H2SO4在反应器I中反应:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;生成HClO4、ClO2和NaHSO4,ClO2在反应器II中与二氧化硫、氢氧化钠反应2ClO2+SO2+4NaOH═2NaClO2+Na2SO4+2H2O;生成亚氯酸钠,再得到其晶体;反应器I中得到的溶液通过冷却过滤得到NaHSO4晶体,滤液为HClO4,蒸馏得到纯净的HClO4.
(1)根据上述分析,操作①为过滤分离晶体和溶液;
(2)常用漂白剂和消毒剂均是利用它们具有强氧化性,能使蛋白质变性;
(3)加入过量的硫酸是为了制得高氯酸,如果硫酸加少了会生成高氯酸钠;
(4)反应器Ⅱ中ClO2与二氧化硫、氢氧化钠反应生成亚氯酸钠;
(5)水的沸点是100℃,HClO4的沸点是130℃,最先蒸馏流出的是水而不是HClO4.
解答 解:NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4,其反应的化学方程式为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;冷却溶液时会降低NaHSO4的溶解度,使NaHSO4结晶析出;高氯酸的沸点低,易挥发,蒸馏可以得到纯净的高氯酸,
(1)根据上述分析,操作①为过滤,
故答案为:过滤;
(2)因为Ca(ClO)2、ClO2、NaClO、NaClO2等均具有强氧化性,常用作消毒剂和漂白剂,故答案为:强氧化性;
(3)反应器Ⅰ中投料时如果硫酸加少了会生成高氯酸钠,加入过量的硫酸是为了制得高氯酸,
故答案为:为了产物能得到HClO4而不是NaClO4;
(4)反应器Ⅱ中ClO2与二氧化硫、氢氧化钠反应生成亚氯酸钠,其反应的离子方程式为:4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O,
故答案为:4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O;
(5)水沸点是100℃,HClO4的沸点是130℃,最先蒸馏流出的是水而不是HClO4,有液体流出时立即收集得到的是谁,不能得到HClO4纯品,因此不合理,
故答案为:不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4;
点评 本题以亚氯酸钠制备为背景,考查了学生阅读题目获取信息的能力、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力,以及在新情境下综合运用知识解决问题的能力,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$2 Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | 4Fe (OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
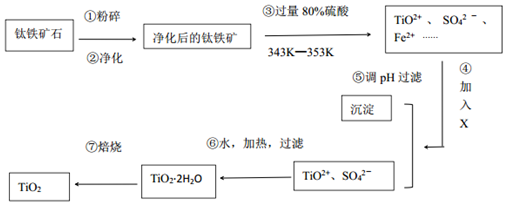
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用活性炭去除冰箱中的异味 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
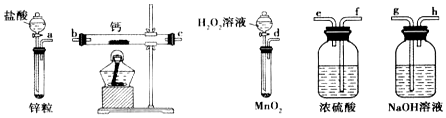

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com