
分析 发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,根据n=$\frac{V}{{V}_{m}}$计算二氧化碳物质的量,再根据方程式计算碳酸钙、HCl的物质的量,根据c=$\frac{n}{V}$计算盐酸浓度,根据m=nM计算碳酸钙质量,进而计算样品中碳酸钙纯度.
解答 解:标况下,896mL二氧化碳物质的量为$\frac{0.896L}{22.4L/mol}$=0.04mol,
CaCO3+2 HCl=CaCl2+CO2↑+H2O
1 1 1
0.04mol 0.08mol 0.04mol
故盐酸的物质的量浓度为$\frac{0.08mol}{0.05L}$=1.6mol/L,
碳酸钙质量为0.04mol×100g/mol=4g,故石灰石样品的纯度为$\frac{4g}{4.5g}$×100%=88.9%,
答:(1)盐酸的物质的量浓度为1.6mol/L;
(2)石灰石样品的纯度为88.9%.
点评 本题考查化学方程式计算,比较基础,旨在考查学生对基础知识的理解掌握.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 | B. | 原子总数 | C. | 碳原子数 | D. | 分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b-2a) mol•L-1 | B. | $\frac{b-2a}{2}$•L-1 | C. | (2b-a)mol•L-1 | D. | $\frac{2b-a}{2}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
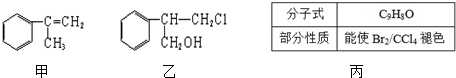
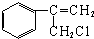 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙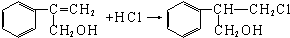 _(不需注明反应条件).
_(不需注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com