
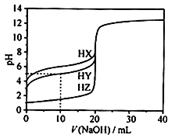
 25��ʱ����0.1000mol•L-1��NaOH��Һ�ֱ�ζ�20.00mL��Ϊ0.1000mol•L-1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵��������ǣ�������
25��ʱ����0.1000mol•L-1��NaOH��Һ�ֱ�ζ�20.00mL��Ϊ0.1000mol•L-1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵��������ǣ�������| A�� | HZ��ǿ�ᣬHX��HY������ | |
| B�� | ���ݵζ����ߣ��ɵ�Ka��HY����10-5 | |
| C�� | ������HX��HY��Һ�������Ϻ���NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ��c��X-����c��Y-����c��OH-����c��H+�� | |
| D�� | ������HY��HZ��Һ�������ϴﵽƽ��ʱ��C��H+��=c��OH-��=c��Z-��+c��Y-�� |
���� A.0.1000mol/L��ǿ�����ȫ���룬һԪ������pHΪ1�������ȫ���룬pH��1������ͼ�������
B������ͼ���μ�NaOH�����Ϊ10mLʱ��HY��Һ��pH=5��������ӦΪNaOH+HY=NaY+H2O��HY�ĵ���ƽ�ⳣ��ΪKa��HY��=$\frac{c��{H}^{+}��c��{Y}^{-}��}{c��HY��}$���ݴ˼��㣻
C��������HX��HY��Һ�������Ϻ���ͼ�������HY������ǿ��HX���ζ���Ӧ�ȷ�ӦHX������NaX��NaYˮ��̶ȷ�����
D��������HY��HZ��Һ�������ϴﵽƽ��ʱ������HY��HZ����������Һ�������Һ��Ȼ�����ԣ��ݴ��жϣ�
��� �⣺A.0.1000mol/L��ǿ�����ȫ���룬һԪ������pHΪ1�������ȫ���룬pH��1������ͼ��HX��pHΪ1��HY��HZ��pH��1�����HXΪǿ�ᣬHY��HZΪ���ᣬ��A��ȷ��
B����0.1000mol/L��NaOH��Һ�ζ�20.00mL 0.1000mol/L��HY��Һ������ͼ��NaOH�μ�10mLʱ����ʱ��Һ�иպ�����NaY��HY���ʵ���1��1������Ϊ��Һ��c��HY����c��Y-����HY�ĵ���ƽ�ⳣ��ΪKa��HY��=$\frac{c��{H}^{+}��c��{Y}^{-}��}{c��HY��}$��10-5����B��ȷ��
C��������HX��HY��Һ�������Ϻ���ͼ�������HY������ǿ��HX���ζ���Ӧ�ȷ�ӦHY����NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ����ʱ��Һ��ΪNaX��NaY���ʵ���1��1��ϵ������HY����ǿ��HX����ˮ��̶�NaX��NaY������Һ��c��Y-����c��X-����ˮ��ʹ��Һ�ʼ��ԣ���c��OH-����c��H+��������Һ������Ũ�ȹ�ϵӦΪ��c��Y-����c��X-����c��OH-����c��H+������C����
D��HY��HZ��Һ�������ϴﵽƽ��ʱ������HY��HZ����������Һ�������Һ��Ȼ�����ԣ���Һ��c��H+����c��OH-������D����
��ѡCD��
���� ���⿼��������ʵĵ���ƽ�⣬ƽ�ⳣ���ļ��㣬��Һ������Ũ�ȴ�С�ıȽϣ����ζ�ԭ����֪ʶ�������ѶȲ����ǻ����⣮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�����Һ�м��������ˮ��Al3++4NH3•H2O�TAlO2-+4NH4++2H2O | |
| B�� | Cl2ͨ��FeCl2��Һ�У�Cl2+Fe2+�T2Cl-+Fe3+ | |
| C�� | ����CO2ͨ�����ʯ��ˮ�У�CO2+2OH-+Ca2+�TCa CO3��+H2O | |
| D�� | ��̼��þ�еμ�ϡ���CO32-+2H+�TCO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ��ʵ | ���� |
| A | �����pH��5.6 | CO2�ܽ�����ˮ�� |
| B | ��������Դ�������о����� | ��ʯȼ��ȼ�շų�������ʹˮ�ֽ�������� |
| C | ���ݡ���������������ֽ | ���ݡ�������������ά�� |
| D | Ư���ڿ����о��ñ��� | Ư���е�CaCl2������е�CO2��Ӧ����CaCO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼�����Ƶ�ˮ�⣺HCO3-+H2O=H3+O+CO32- | |
| B�� | 14g��ϩȼ������Һ̬ˮ����b kJ���������ʾ��ȼ���ȵ��Ȼ�ѧ����ʽΪ��C2H4��g��+3O2��g���T2H2O��g��+2CO2��g����H=-2b kJ•mol-1 | |
| C�� | ������ͭ��������2H++2Cl-$\frac{\underline{\;���\;}}{\;}$H2��+Cl2�� | |
| D�� | �����Ե⻯������Һ��ͨ������������4I-+O2+4H+=2I2+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��֪��pKa=-lgKa��25��ʱ��H2A��pKal=1.85��pKa2=7.19�������£���0.1mol•L-1NaOH��Һ�ζ�20mL 0.1mol•L-1H2A��Һ�ĵζ�������ͼ��ʾ������˵����ȷ���ǣ�������
��֪��pKa=-lgKa��25��ʱ��H2A��pKal=1.85��pKa2=7.19�������£���0.1mol•L-1NaOH��Һ�ζ�20mL 0.1mol•L-1H2A��Һ�ĵζ�������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | a��������Һ�У�V0=10 mL | |
| B�� | b��������Һ�У�c��H2A��+c��H+��=c��HA-��+c��OH-�� | |
| C�� | c��������Һ�У�c��A2-��=c��HA-�� | |
| D�� | d��������Һ��A2-ˮ��ƽ�ⳣ��Khl=10-7.19 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ŵ�ʱ��������ӦΪʽ��O2+4e-+4H+�T2H2O | |
| B�� | �ŵ�ʱ��������ӦΪʽ��CH3OH-6e-+8OH-�TCO32-+6H2O | |
| C�� | ���ʱ��ԭ��صĸ������Դ������������ | |
| D�� | ���ʱ��������ӦʽΪ��4OH--4e-�T2H2O+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������SO2ͨ��NaClO��Һ�У�SO2+ClO-+H2O=HClO+HSO3- | |
| B�� | ˫��ˮ�����ȼ�����������ˮ�е�������Cl2+H2O2=2HCl+O2 | |
| C�� | �ö��Ե缫��ⱥ���Ȼ�þ��Һ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2OH- | |
| D�� | ��84����Һ���͡�����顱����Ҫ�ɷ�Ϊ���ᣩ���ʹ�û�����ж����壺ClO3-+5Cl-+6H+=3Cl2��+3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com