
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |




 ,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r( S2-)>r(Cl-)>r(O2-)故答案为:
,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r( S2-)>r(Cl-)>r(O2-)故答案为: ;
; ,故答案为:
,故答案为: .
.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为部分短周期元素的原子半径及其主要化合价,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省渭南市高三第二次模拟理综化学试卷(解析版) 题型:推断题
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题:
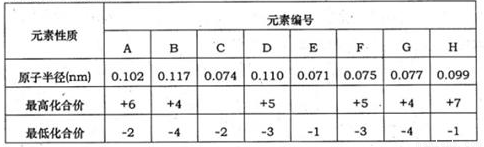
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com