
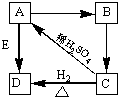
 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内. FeS+2O2↑,故答案为:FeSO4
FeS+2O2↑,故答案为:FeSO4 FeS+2O2↑;
FeS+2O2↑; FeO+SO3↑,故答案为:FeSO4
FeO+SO3↑,故答案为:FeSO4 FeO+SO3↑.
FeO+SO3↑.

科目:高中化学 来源: 题型:
 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 ( I)下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
( I)下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.查看答案和解析>>
科目:高中化学 来源:2015届四川省高一上学期入学考试化学试卷(解析版) 题型:选择题
分类是学习化学的方法之一.下列各组物质是按单质、氧化物、混合物、盐的顺序排列的是( )
A.氧气、水、空气 、氢氧化钠 B.氮气、氯酸钾、钢、醋酸钠
C.可燃冰、干冰、冰水混合物、氯化锰 D.石墨、生石灰、石油、小苏打
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省宜春市上高二中高一(上)第二次月考化学试卷(解析版) 题型:填空题
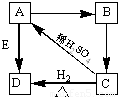
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com