
 .
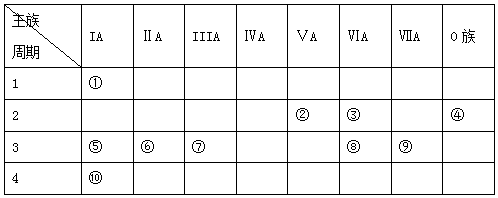
.分析 由元素在周期表的位置可知,①~⑩种元素分别为H、N、O、Ne、Na、Mg、Al、S、Cl、K,
(1)稀有气体的性质最不活泼,H的原子半径最小,S的质子数为16;
(2)非金属性越强,对应最高价氧化物对应水化物的酸性越强;金属性越强,最高价氧化物对应水化物的碱性越强;氢氧化铝为两性氢氧化物,与强酸、强碱反应;
(3)非金属性越强,对应氢化物的还原性越弱;
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物,反应生成偏铝酸钠和水;
(5)与变价金属反应或单质之间的置换反应均可比较非金属性.
解答 解:由元素在周期表的位置可知,①~⑩种元素分别为H、N、O、Ne、Na、Mg、Al、S、Cl、K,
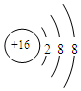
(1)化学性质是不活泼的元素名称是氖,元素原子半径最小的是H,⑧号元素的离子结构示意图为 ,
,
故答案为:氖;H; ;
;
(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3,
故答案为:HClO4;KOH;Al(OH)3;
(3)非金属性Cl>S,则⑧、⑨号元素的氢化物中还原性较强的是H2S,故答案为:H2S;
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物,反应生成偏铝酸钠和水,反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(5)能说明⑨的非金属性比⑧强的一个实验实事为Cl2与铁反应生成FeCl3,而S与铁反应生成FeS 或Cl2与H2S(或Na2S)反应有淡黄色沉淀生成,
故答案为:Cl2与铁反应生成FeCl3,而S与铁反应生成FeS 或Cl2与H2S(或Na2S)反应有淡黄色沉淀生成.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
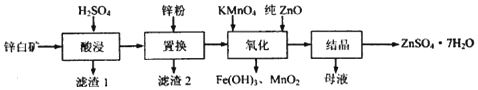
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
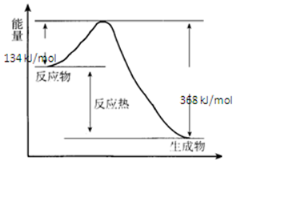 (1)下列反应中,属于吸热反应的是④⑤⑦.
(1)下列反应中,属于吸热反应的是④⑤⑦.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
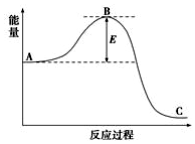 工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:
工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
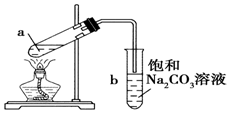
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是加快反应速率并及时将乙酸乙酯蒸出 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
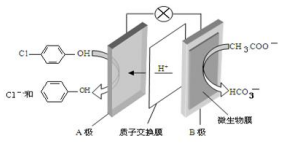 现在污水治理越来越引起人们重视,可以通过
现在污水治理越来越引起人们重视,可以通过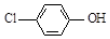 膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.
膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为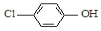 +e-═Cl-+ +e-═Cl-+ | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.1NA | |
| D. | B极为电池的正极,发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com