
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”而独享2011年诺贝尔化学奖以及奖金。现在,准晶体已在很多应用领域“大展拳脚”,可用来制造不粘锅、发光二极管、热电转化设备等。
(1)铁在周期表中的位置 ,铝的原子结构示意图为 ;
(2)工业炼铝用的原料是 (填Al2O3或AlCl3),不用另一种的原因是
;
(3)铜在潮湿的空气中会生成铜绿,写出该反应方程式
;
(4)用电解法制Fe(OH)2沉淀,下列可做电解质溶液的是
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(1)第四周期Ⅷ族 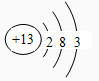
(2)Al2O3 AlCl3是共价化合物,在熔融状态下不导电
(3)2Cu + CO2 + O2 + H2O = Cu2(OH)2CO3
(4)B C
解析试题分析:(1)Fe在元素周期表中位于第四周期、第Ⅷ族;Al的原子结构示意图是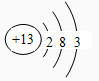 ;
;
(2)工业炼铝用的原料是Al2O3不是AlCl3,因为AlCl3是共价化合物,在熔融状态下不导电
(3)铜绿的成分是Cu2(OH)2CO3,是Cu与空气中的氧气、水、二氧化碳反应的产物,化学方程式为
2Cu + CO2 + O2 + H2O = Cu2(OH)2CO3
(4)A、纯净水的离子浓度较小,不适宜做电解质溶液,错误;B、NaCl溶液作电解质溶液,阳极是Fe放电,阴极是H+放电,能生成Fe(OH)2沉淀,正确;C、氢氧化钠溶液作电解质溶液,阳极是Fe放电,阴极是氢离子放电,能生成Fe(OH)2沉淀,正确;D、氯化铜作电解质溶液,阳极是Fe放电,阴极是铜离子放电,溶液的OH-离子浓度不变,不能生成Fe(OH)2沉淀,错误,答案选BC。
考点:考查工业制铝的方法,元素的位置及原子结构示意图的书写,铜绿的生成,电解质溶液的选择


科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)有短周期元素A、B、C、D、E、F六种短周期元素,其原子序数依次增大。其中A是周期表中原子半径最小的元素,B的核外有两个电子层,其核外电子数为两层电子数之差的三倍;A、E和D、F分别同族。D的最外层电子数等于B的原子序数。试根据以上叙述回答:
(1)写出元素符号:C____________、D____________、E_____________、F_____________;
(2)写出由A、D、E、F四种元素组成的两种盐反应的离子方程式________________________;
(3)E单质点燃时生成的淡黄色固态化合物与水反应的化学方程式:______;
(4)A与C的最低价形成的化合物为M:
① 设计简单实验验证M的浓溶液的酸碱性________________________。(写出操作、现象和结论)
②写出M催化氧化的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示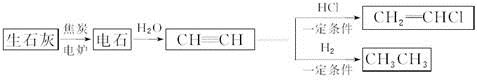
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。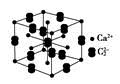
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
| R | 有多种化合价,其最高正价为+6价 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。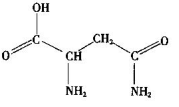
(1)天冬酰胺所含元素中_______(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有_______种。
(3)H2S和H2Se的参数对比见下表。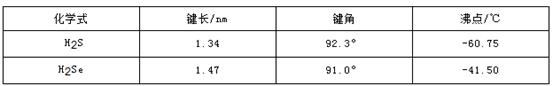
①H2Se的晶体类型为_________,含有的共价键类型为_________。
②H2S的键角大于H2Se的原因可能为____________________。
(4)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
A是____________(填元素符号),B的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
| A.①③⑤ | B.②④ | C.①③ | D.②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com