
【题目】下列物质的用途主要利用了其化学性质的是( )
①酒精用作燃料;②干冰用于人工降雨;③O2用于医疗急救;④稀有气体填充霓虹灯。
A.①③④B.①③C.③④D.②③④
科目:高中化学 来源: 题型:
【题目】将气体A、B置干容积为2L的密用容器中发生如下反应:4A(g)+B(g)![]() 2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
A. 0.025mol·L-1·s-1c. B. 0.0125 mol·L-1·s-1
C. 0.05 mol·L-1·s-1 D. 0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
①当反应达到平衡时, N2和H2的转化率之比为________。
②保持体积不变,升高平衡体系的温度,混合气体的平均相对分子质量__________ (填“变大”、“变小”或“不变”) 。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
(2)在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

①温度T1________T2(填“大于”“等于”或“小于”)。
②正反应是________反应(填“吸热”或“放热”)。
③如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
④当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(3)工业上用净化后的水煤气在催化剂作用下制取氢气:CO(g)+H2O(g)![]() H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入2 L密闭容器中,体系中各物质的浓度随时间的变化如图所
H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入2 L密闭容器中,体系中各物质的浓度随时间的变化如图所
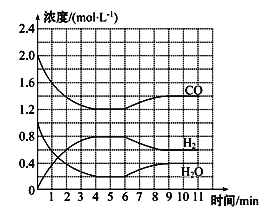
①在0~4 min时段,反应速率v(H2O)为_________。
②该反应到4 min时,CO的转化率为________。
③若6 min时改变的外部条件为升温,则该反应的ΔH__________0(填“>”“=”或“<”)。
④判断该反应达到化学平衡状态的依据是_______。
a.混合气体的密度不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.5 molL -1 盐酸与50 mL0.55 mol L -1 NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。

(2)烧杯间填满碎纸条的作用是______________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值_______(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 molL -1 盐酸跟50 mL 0.55 molL -1 NaOH溶液进行反应,与上述实验相比,所放出的热量 _______(填“相等”或“不相等”),所求中和热 _____(填“相等”或“不相等”),简述理由_______________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________;用0.50 molL -1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会__________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。 I.已知:氧化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C 元素的非金属性强弱:____________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________________。
II.工业制备硫代硫酸钠的反应原理为2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如下图所示装置制备Na2S2O3。
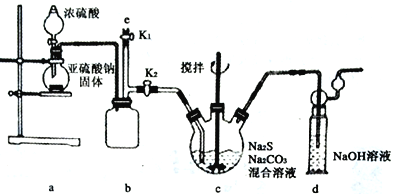
(1)实验中要控制SO2 生成速率,可采取的措施有_______________________(写出一条)。
(2)b装置的作用是____________________________________。
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为___________(填化学式)。
(4)实验结束后,在e处最好连接盛_________(填“NaOH 溶液”、“水”、“CCl4” 中一种)的注射器,接下来的操作为关闭K2 打开K1,最后拆除装置。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取200.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,
用1.00×10-4mol/L 的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定终点的现象:________________________________________。
(6)处理后的废水是否达到排放标准:_______________________________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
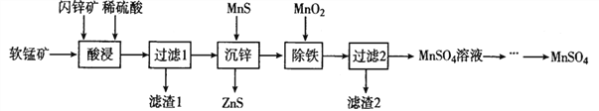
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。
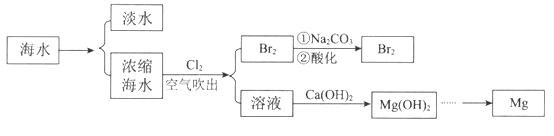
(1)海水淡化的方法有_________________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2:
3Br2+ 6Na2CO3+3H2O= 5NaBr+ NaBrO3+6NaHCO3。当吸收3 mol Br2时,反应中转移的电子数是_____________。
(3)海水中部分离子的含量如下:
成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是____________。若要从100 L的海水中提取镁,理论上需要加入沉淀剂Ca(OH)2的质量是_______________。
(4)由Mg(OH)2制单质Mg,以下方法最合适的是________________(填序号)。
A.Mg(OH)2 ![]() MgO
MgO![]() Mg
Mg
B.Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C.Mg(OH)2![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
D.Mg(OH)2 ![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
A.+4 B.+3 C.+2 D.+1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com