
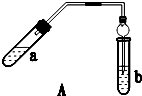
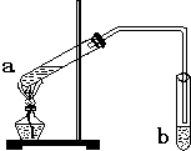
 ʵ������������������Ҫװ����ͼA��ʾ����Ҫ�������a�Թ��а�2��3��2�����������Ũ���ᡢ�Ҵ�������Ļ����ڰ�Aͼ����װ�ã�ʹ����������������ͨ��b�Թ���ʢ�ı���̼������Һ�����뼸�η�̪��Һ���У���С�����a�Թ��еĻ��Һ���ܵ�b�Թ����ռ���Լ2mL����ʱֹͣ���ȣ�����b�Թܲ�������Ȼ���ô�����Һ��ֲ㣻�ݷ��������������������
ʵ������������������Ҫװ����ͼA��ʾ����Ҫ�������a�Թ��а�2��3��2�����������Ũ���ᡢ�Ҵ�������Ļ����ڰ�Aͼ����װ�ã�ʹ����������������ͨ��b�Թ���ʢ�ı���̼������Һ�����뼸�η�̪��Һ���У���С�����a�Թ��еĻ��Һ���ܵ�b�Թ����ռ���Լ2mL����ʱֹͣ���ȣ�����b�Թܲ�������Ȼ���ô�����Һ��ֲ㣻�ݷ��������������������| ʵ�� ��� | �Թ�a���Լ� | �Թ�b���Լ� | ����л���ĺ��/cm |
| A | 3mL�Ҵ���2mL���ᡢ1mL 18mol•L-1 Ũ���� | ����Na2CO3��Һ | 5.0 |
| B | 3mL�Ҵ���2mL���� | 0.1 | |
| C | 3mL�Ҵ���2mL���ᡢ6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL�Ҵ���2mL���ᡢ���� | 1.2 |
���� ��1��������̼���Ʒ�Ӧ���ɶ�����̼�������ƺ�ˮ��
��2�����ᡢ�Ҵ�������̼������Һ���ᵼ��װ���������С������������������������ˮ��Һ�ֲ㣬���뻥�����ܵ�Һ���ȡ��Һ������
��3����ͨ������ʵ�飬֤��H+��������Ӧ���д����ã�Ӧ��֤������Ũ����������ʵ�����ȣ�
�ڶԱ�Ũ���ᡢϡ���������������������Ķ��٣�˵��Ũ����Ũ�������ˮ���ܹ���������������ʣ�����ƽ���ƶ�ԭ��������
�����ᡢ�Ҵ��ӷ���Ҳ���ܷ�����������Ӧ��
���������������ԡ����������¾����Է���ˮ�⣬Ӧѡ�����Ը������
��� �⣺��1��������̼���Ʒ�Ӧ���ɶ�����̼�������ƺ�ˮ����ѧ����ʽ��2CH3COOH+CO32-=2CH3COO-+H2O+CO2����
�ʴ�Ϊ��2CH3COOH+CO32-=2CH3COO-+H2O+CO2����
��2�����ᡢ�Ҵ�������̼������Һ���ᵼ��װ���������С�����������������θ���ܻ����Է�ֹ����������������ˮ��Һ�ֲ㣬���뻥�����ܵ�Һ���ȡ��Һ��������������Ϊ��Һ©����
�ʴ�Ϊ����ֹ��������Һ©����
��3����ͨ������ʵ�飬֤��H+��������Ӧ���д����ã�Ӧ��֤������Ũ����������ʵ�����ȣ���HCl��Ũ��Ϊ3mol/L��2=6mol/L���������Ϊ6mL��
�ʴ�Ϊ��6��6��
�ڴ���ΪŨ���������л����ȱ�3mol•L-1 H2SO4ʱ�����л����Ⱥ�˵��Ũ����Ũ�������ˮ���ܹ���������������ʣ�ԭ���ǣ�Ũ�����������������Ӧ�����ɵ�ˮ��������������Ũ��ʹƽ�����������������ķ����ƶ���
�ʴ�Ϊ��AC��Ũ�����������������Ӧ�����ɵ�ˮ��������������Ũ��ʹƽ�����������������ķ����ƶ���
�����ᡢ�Ҵ��ӷ����¶ȹ��ߴ������ᡢ�Ҵ�δ����Ӧ�����뷴Ӧ��ϵ�����¶ȹ��߷���������Ӧ�����²��ʽ��ͣ�
�ʴ�Ϊ���������ᡢ�Ҵ�δ����Ӧ�����뷴Ӧ��ϵ���¶ȹ��߷���������Ӧ��
���������������ԡ����������¾����Է���ˮ�⣬Ӧѡ�����Ը������
��ѡ��B��
���� ���⿼���л����Ʊ�ʵ�顢̽��ʵ�飬��3����ע�����ÿ��Ʊ������������ۺϿ���ѧ��ʵ������������������֪ʶǨ�������������Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʦ���и߶���10���¿���ѧ���������棩 ���ͣ�ѡ����
һ �������£��ü�������������������NOx������Ⱦ����֪��
�������£��ü�������������������NOx������Ⱦ����֪��
��CH4��g����4NO2��g�� ��4NO��g����CO2��g����2H2O��g�� ��H1����574kJ��mol��1
��CH4��g����4NO��g�� ��2N2��g����CO2��g����2H2O��g�� ��H2����1160kJ��mol��1������ѡ����ȷ����
A��CH4��g����2NO2��g�� ��N2��g����CO2��g����2H2O��g�� ��H����867kJ
B��CH4��g����4NO2��g�� ��4NO��g����CO2��g����2H2O��l�� ��H3����H1
C������0.2mol CH4��ԭNO2��N2����Ӧ�зų�������һ��Ϊ173.4kJ
D�����ñ�״����2.24L CH4��ԭNO2��N2������������ת�Ƶĵ���Ϊ0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
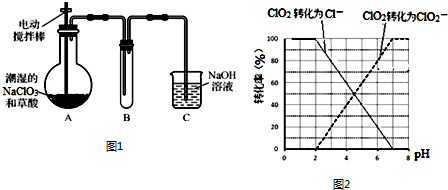
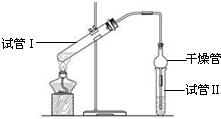 ������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ʵ����������ͼ��װ���Ʊ�����������
������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ʵ����������ͼ��װ���Ʊ�����������| ʵ���� | �Թܢ����Լ� | �Թܢ����Լ� | �л���� ���/cm |
| A | 2mL�Ҵ���1mL���ᡢ 1mL18mol•L-1 Ũ���� | ����Na2CO3 ��Һ | 3.0 |
| B | 2mL�Ҵ���1mL���� | 0.1 | |
| C | 2mL�Ҵ���1mL���ᡢ 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL�Ҵ���1mL���ᡢ���� | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
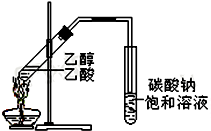 �����dzµ��㡱��������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ����������ͼ��ʾ��װ����ȡ�����������ش��������⣺
�����dzµ��㡱��������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ����������ͼ��ʾ��װ����ȡ�����������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 | ����ֱ��/nm | ������H2O�Ľ����E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �����dzµ��㡱��������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ���Ʊ�������a�м��Ҵ��������Ũ���ᣬ���Թ�b�м���7mL����̼������Һ�����Ӻ�װ�ã��þƾ��ƶ��Թ�a���ȣ����۲쵽�Թ�b������������ʱֹͣʵ�飮�ش��������⣺
�����dzµ��㡱��������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ���Ʊ�������a�м��Ҵ��������Ũ���ᣬ���Թ�b�м���7mL����̼������Һ�����Ӻ�װ�ã��þƾ��ƶ��Թ�a���ȣ����۲쵽�Թ�b������������ʱֹͣʵ�飮�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ���У���ϩ����������Ӱ��÷�Ӧ�ķ�Ӧ�ʱ��H | |
| B�� | 0.5 mol H2O��l�� ��ȫ��Ӧ�ų�������Ϊ22.9 kJ | |
| C�� | 1 mol C2H5OH��g�������������1 mol C2H4��g����1 mol H2O ��g������������� | |
| D�� | 1 mol C2H4��g����1 mol H2O ��g���л�ѧ�����ܼ��ܴ���1 mol C2H5OH��g���л�ѧ�����ܼ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com