
 |
0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/mol?L-1 | 0.100 | a | 0.5b | 0.4b | ||
| c(NO2)/mol?L-1 | 0 | 0.060 | b | c1 | c2 | c3 |
| c(H2SiO4) |
| c(SiO2).c2(H2O) |
| c(H2SiO4) |
| c(SiO2).c2(H2O) |
| △n |
| △t |
| △n |
| △t |
| (0.100-0.070)mol/L |
| 20s |
| x2 |
| (0.100-x) |
| 0.120×0.120 |
| 0.4×0.1 |
| (0.100-0.1×0.4)mol/L |
| 0.1mol/L |
| c(H2SiO4) |
| c(SiO2).c2(H2O) |
| c(H2SiO4) |
| c(SiO2).c2(H2O) |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:高中化学 来源: 题型:
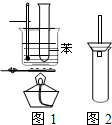 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)
某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)查看答案和解析>>
科目:高中化学 来源: 题型:
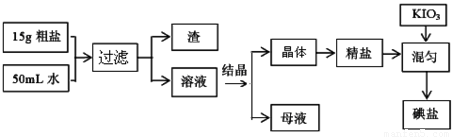
(10分)制取碘盐的流程如下:
试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是 ▲ 。
(2)过滤时,用到的玻璃仪器有: ▲ 、 ▲ 、 ▲ 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: ▲ mg/Kg(保留一位小数),是否是合格产品 ▲ (填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是 ▲ 。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式: ▲ 或 ▲ 。
查看答案和解析>>
科目:高中化学 来源:江苏省盐城中学2010届高三年级第一次模拟考试化学试题 题型:填空题
(10分)制取碘盐的流程如下:
试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是 ▲ 。
(2)过滤时,用到的玻璃仪器有: ▲ 、 ▲ 、 ▲ 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: ▲ mg/Kg(保留一位小数),是否是合格产品 ▲ (填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是 ▲ 。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式: ▲ 或 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市宝山区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
食用加碘盐的生产流程如下:
(1)检验母液中是否含有SO42-离子的方法是 。
(2)过滤时,用到的玻璃仪器有: 、 、 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计):出厂产品≥40mg/Kg;销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1 h,即得碘盐产品,该碘盐的含碘量约为______mg/Kg(保留一位小数),是否为合格产品 (选填“合格”或“不合格”)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O→3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要使用的一种试剂是 。
(5)使用碘盐时,要防止高温,是因为:① 碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体中加硝酸酸化的硝酸银溶液有黄色沉淀生成;② 碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色。根据以上信息写出①、②中发生反应的化学方程式:
① ;
② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com