
【题目】在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应: N2O4(g)![]() NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。
NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。

(1)在0-60s这段时间内,以N2O4表示的平均反应速率为_______mol·L-1·s-1
(2)上述反应的平衡常数表达式为______,升高温度K值______ (填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是______ (填选项序号)。
A.降低温度 B.通人氦气使其压强增大 C.又往容器中充入N2O4 D.使用催化剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
AgBr(s) | 5,0×10-13 mol2·L-2 |
AgI(s) | 8.3×10-17 mol2·L-2 |
FeS(s) | 6.3×10-18 mol2·L-2 |
ZnS(s) | 1.6×10-24 mol2·L-2 |
CuS(s) | 1.3×10-36 mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为:____________________。
(2)向饱和的AgI溶液中加入固体硝酸银,则c( I- )________(填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是_____________________(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4![]() MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A. MoS2煅烧产生的尾气可直接排空
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的描述你认为正确的是:
A.含碳元素的化合物一定是有机化合物
B.乙烷和乙烯互为同系物
C.苯分子含有碳碳双键,所以可以使酸性高锰酸钾褪色
D.正丁烷和异丁烷互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:____________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是___________,它与溴水反应的化学方程式是___________________,在验证过程中必须全部除去。
(4)请你选用下列四个装置(见下图,可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
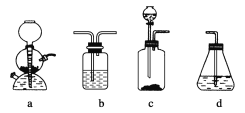

(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性。理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子半径的大小顺序正确的是( )
①2s22p2 ②3s23p3 ③2s22p4 ④3s23p2
A. ③>④>②>① B. ④>③>②>①
C. ④>③>①>② D. ④>②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种气态烃,其中A、B、C都能使酸性高锰酸钾溶液褪色;1mol C能与2mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子;A与C具有相同的通式;A与H2加成可得B,B与相同条件下N2的密度相同;D是最简单的有机物,E是D的同系物,完全燃烧相同物质的量的B或E生成CO2的量相同。
(1)试确定A、B、C、D、E的结构简式:
A:_____;B:_____;C:_____;D:_____;E:_____。
(2)等质量的A、B、C、D、E完全燃烧,耗氧量最多的是______(填名称,下同)生成二氧化碳最多的是______。
(3)等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是____(填名称,下同),生成水最多的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(能力挑战题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30,D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的名称。
A ,B ,C ,D ,E 。
(2)用电子式表示离子化合物A2B的形成过程:_________ ____________。
(3)写出D元素形成的单质的结构式: ____________________。
(4)写出下列物质的电子式:
E与B形成的化合物: ;A、B、E形成的化合物: ;D、E形成的化合物: ___________。
(5)A、B两元素组成的化合物A2B2属于 (填“离子”或“共价”)化合物,存在的化学键是 ,写出A2B2与水反应的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com