
| A. | 在常温常压下,11.2 L O2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 71 g Cl2所含原子数为2NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、氦气为单原子分子;
C、氯气由氯原子构成;
D、标况下水为液态.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,故分子个数小于0.5NA个,故A错误;
B、氦气为单原子分子,故1mol氦气中含NA个原子,故B错误;
C、氯气由氯原子构成,故71g氯气中含有的氯原子的物质的量为2mol,个数为2NA个,故C正确;
D、标况下水为液态,故1mol水的体积小于22.4L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
| 开始沉淀时 | 3.8 | 5.8 | 2.2 | 10.6 |
| 完全沉淀时 | 4.7 | 8.3 | 4.0 | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡时容器内气体压强减小 | |
| C. | 若降温,该反应的平衡常数增大 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
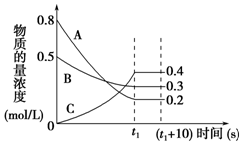
| A. | t1s时反应物A的转化率为60% | |
| B. | 在t1~(t1+10)s时,v(A)=v(B)=0 | |
| C. | 该反应的化学方程式为3A+B?2C | |
| D. | 0~t1s内A的反应速率为v(A)=$\frac{0.2}{{t}_{1}}$mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴加入冷水中直接就能制得Fe(OH)3胶体 | |
| B. | 胶体区别于其它分散系的本质特征是胶体粒子的直径大小 | |
| C. | 用过滤的方法可以分离和提纯胶体 | |
| D. | 煮鸡蛋的过程中发生了胶体的电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com