
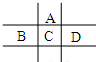
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:分析 A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl;1molE单质与足量酸作用,在标准状况下能产生33.6LH2,设E的化合价为y,根据电子转移守恒:1mol×y=$\frac{33.6L}{22.4L/mol}$×2×1,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl;1molE单质与足量酸作用,在标准状况下能产生33.6LH2,设E的化合价为y,根据电子转移守恒:1mol×y=$\frac{33.6L}{22.4L/mol}$×2×1,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al.
(1)由上述分析可知,A为氧、B为磷、C为硫、D为氯、E为铝,
故答案为:氧;磷;硫;氯;铝;
(2)B单质(磷)在D单质(氯气)中燃烧,反应现象是:白色烟雾,生成物的化学式为:PCl3、PCl5,
故答案为:白色烟雾;PCl3、PCl5;
(3)D与E形成的化合物为AlCl3,化学键类型是共价键,
故答案为:共价键;
(4)D与E形成的化合物为AlCl3,向AlCl3水溶液中滴入烧碱溶液直至过量时,先后发生反应:Al3++3OH-=Al(OH )3↓、Al(OH )3+OH-=AlO2-+2H2O,看到的现象为:产生白色沉淀后逐渐溶解,
故答案为:产生白色沉淀后逐渐溶解;Al3++3OH-=Al(OH )3↓、Al(OH )3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表和元素周期律,元素的推断是解答本题的关键,注意理解同主族元素质子数关系,注意利用电子守恒确定元素化合价,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 湿法冶铜:Fe+CuSO4═FeSO4+Cu | |
| B. | 高炉炼铁:Fe2O3+3CO═2Fe+3CO2 | |
| C. | 制氧气:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | |
| D. | 制环氧乙烷:2C2H2( 乙炔)+O2$\frac{\underline{\;催化剂\;}}{加热}$2C2H4O ( 环氧乙烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C3H6 C2H4 | B. | C2H4 C2H6 | C. | C3H8 C3H6 | D. | C6H6 C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前,两溶液由水电离的H+浓度相同 | |
| B. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) | |
| C. | 若醋酸溶液加水稀释,溶液中各离子浓度与c(CH3COO-)/c(H+)均减小 | |
| D. | 相同温度,相同浓度的CH3COONH4 与 NaCl溶液,对水的电离程度的影响前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会期间,处理废水时加入明矾可作为混凝剂以吸附水中的悬浮物杂质且有杀菌消毒的作用 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博会中国馆--“东方之冠”使用了大量钢筋混凝土,混凝土是混合物 | |
| D. | 世博停车场安装光电设施,可将阳光转化为电能以供应照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氧化铝和氢氧化钠溶液反应:Al2O3+OH-═AlO2-+H2O | |
| D. | 稀硝酸溶液中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com