
 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2012?������һģ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺���˷���Ŀ�ѧ�о�Ϊ�����ᳫ�ġ���̼���ʽ���ṩ���ݣ��밴Ҫ��ش��������⣺
��2012?������һģ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺���˷���Ŀ�ѧ�о�Ϊ�����ᳫ�ġ���̼���ʽ���ṩ���ݣ��밴Ҫ��ش��������⣺
| ||
| ||
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | |
| N2 | 8.00 | 7.40 | 7.00 | 6.72 | 6.52 | 6.36 | 6.20 | 6.00 | 6.00 | 6.00 |
| CO | 0.00 | 1.80 | 3.00 | 3.84 | 4.22 | 4.92 | 5.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��ʼŨ�� | �� | �� | �� |
| c��H2��/mol/L | 0.010 | 0.020 | 0.020 |
| c��CO2��/mol/L | 0.010 | 0.010 | 0.020 |
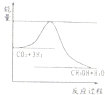
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.2X2+Y2====2Z B.X2+Y2====2Z
C.2X2![]() Y2+2Z D.3X2+6Y2====2Z
Y2+2Z D.3X2+6Y2====2Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ĵ�ʡ�����и�����һ������Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶������ݻ�������ܱ������У�����aX��g��+bY��g�� cW��g����Ӧ��������1 mol X��lmol Y���ﵽƽ��ʱ��W��Ũ��Ϊ0��2 mol/L������˵���������
cW��g����Ӧ��������1 mol X��lmol Y���ﵽƽ��ʱ��W��Ũ��Ϊ0��2 mol/L������˵���������
A���ﵽƽ��ʱ������b mol Y��ͬʱ����c moI W
B���������¶ȣ�W�����ʵ���Ũ�ȼ�С����÷�Ӧ��H<0
C������ʼͶ��X��Y�����ʵ����ֱ�Ϊamol��bmol����ƽ��ʱX��Y��ת�������
D������ͬ�����£��ٳ���l mol X��1 mol Y������ƽ��ʱ��W��Ũ��Ϊ0��4 mol/L����a+b>c
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com