

| A、气体甲的摩尔质量为44 |
| B、沉淀甲是硅酸和硅酸钙的混合物 |
| C、K+、CO32-、A102-和SiO32-一定存在于溶液X中 |
| D、SO42-一定不存在于溶液X中 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

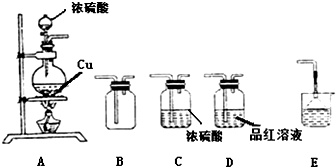
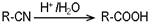 .请回答下列问题:
.请回答下列问题: ),请设计合成路线(无机试剂及溶剂任选).
),请设计合成路线(无机试剂及溶剂任选).| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠和氯化镁溶液分别与硝酸银溶液混合都能产生白色沉淀 |
| B、浓硫酸和稀盐酸长期暴露在空气中浓度降低 |
| C、氯水和活性炭使红墨水褪色 |
| D、漂白粉和水玻璃长期暴露在空气中变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | A | B | C |
| 发生装置 |  |  |  |
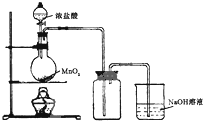
查看答案和解析>>
科目:高中化学 来源: 题型:
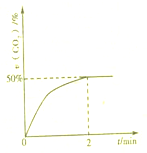 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3是氧化剂 |
| B、1mol KClO3参加反应时有10mol电子转移 |
| C、该反应中的H2SO4只体现酸,不体现氧化性 |
| D、发生氧化反应与还原反应的氯元素的质量比为5:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com