
黄铜矿(主要成分为CuFeS2 ,S为-2价)是工业炼铜的主要原料,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,设计了如下实验:

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,发生如下反应:
实验后取d中溶液的 置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)中氧化产物是 ,当生成0.3molSO2气体时,转移电子 mol。
(2)将样品研细后再反应,其目的是 ;装置c的作用是 。
(3)用标准碘溶液滴定d中溶液的离子方程式是 ,滴定达终点时的现象是 。
(4)上述反应结束后,仍需通一段时间的空气,其目的是 。
(5)通过计算可知,该黄铜矿的纯度为 。
(6)若将原装置d中的试液换为Ba(OH)2溶液,测得黄铜矿纯度偏高,假设实验操作均正确,可能的原因主要是 。
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做
一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。
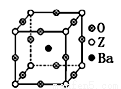
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
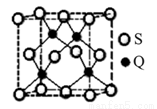
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。
查看答案和解析>>
科目:高中化学 来源:2016届天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.反应A(g) ? 2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea- Eb)kJ/mol
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20%
D.将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,始终保持增大
查看答案和解析>>
科目:高中化学 来源:2016届天津市和平区高三第二次模拟考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
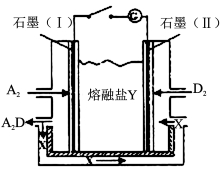
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO 4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三4月质检理综化学试卷(解析版) 题型:实验题
[化学——选修5:有机化学基础]
F、G都是常见的高分子材料,以下是由丙烯合成F、G的流程图。
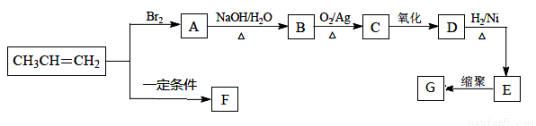
(1)E的化学名称是 ,所含官能团是 。
(2)G的结构简式是 。
(3)A→B的化学方程式是 ,该反应类型是 。
(4)由CH3CH=CH2生成F的化学方程式是 ,该反应类型是 。
(5)在一定条件下,两分子E脱去两分子水形成一种六元环状化合物,该化合物的结构简式是 。
(6)C的同分异构体有多种,请分别写出符合下列条件有机物的结构简式:
①能与NaHCO3溶液反应的是 ;
②能发生水解反应的是 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三4月质检理综化学试卷(解析版) 题型:选择题
X 、Y 、Z 、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z元素金属性最强,R原子的核外电子数是X、Z核外电子数之和。下列叙述一定正确的是
A.含氧酸酸性R>X B.简单氢化物稳定性Y<X
C.最高正化合价Z< X <Y< R D.由Z和R形成的化合物为离子化合物
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三5月模拟一理综化学试卷(解析版) 题型:实验题
某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
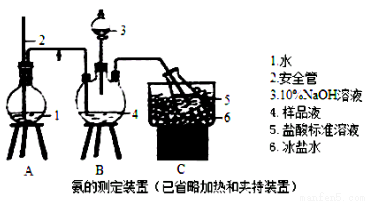
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL NaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题::
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1,c(CrO42-)为 mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南嘉积中学高二下期中理科化学试卷(解析版) 题型:选择题
在卤代烃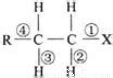 中,有关化学键的叙述,下列说法不正确的是
中,有关化学键的叙述,下列说法不正确的是
A.当该卤代烃发生取代反应时,被破坏的键一定是①
B.当该卤代烃发生消去反应时,被破坏的键一定是①和③
C.当该卤代烃在碱性条件下发生水解反应时,被破坏的键一定是①
D.当该卤代烃发生消去反应时,被破坏的键一定是①和④
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:选择题
下列实验装置或操作正确的是

A.图①向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2-
B.图②两支试管中的蛋白质济液均会变性
C.图③装置用来除去C2H4中的杂质SO2
D.图④装置用来灼烧海带成灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com