
【题目】利用如图所示的装置收集以下7种气体:①H2 ②Cl2 ③O2 ④HCl ⑤NH3 ⑥NO ⑦NO2
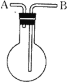
⑴若烧瓶是干燥的,则由B口进气,可收集的气体有___,若把装置颠倒,由A口进气,可收集的气体有____。
⑵若在烧瓶内充满水,可收集的气体有____,气体应由____口进入。
⑶若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有____,气体应由____口进入。
【答案】②③④⑦ ①⑤ ①③⑥ A ①②③④⑥⑦ B
【解析】
(1)烧瓶是干燥,从B口进气是收集密度比空气大且常温下和空气中氧气不反应的气体;若从A口进气则收集密度比空气小的气体,与氧气不反应,且密度与空气密度相差较大;
(2)若烧瓶充满水,可收集的气体不溶于水,且与水不反应,并且从A口进;
(3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体不能与之反应,同时从B口进气。
(1)烧瓶是干燥,从B口进气是收集密度比空气大且常温下和空气中氧气不反应的气体,满足条件的气体有②③④⑦;若从A口进气则收集密度比空气小的气体,用排气法收集的气体必须与氧气不反应,且密度与空气密度相差较大,满足条件的有①⑤,故答案为:②③④⑦;①⑤;
(2)若烧瓶充满水,可收集的气体不溶于水,且与水不反应,满足条件的气体有①③⑥,用排水法收集气体时,气体应从短导管进,即应从A口进,故答案为:①③⑥;A;
(3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体不能与之反应,有①②③④⑥⑦,同时必须从B口进气,故答案为:①②③④⑥⑦;B。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列各溶液中,下列有关说法正确的是
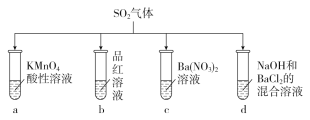
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,说明SO2具有还原性
D. 试管d中能产生白色沉淀,加入稀硝酸后沉淀完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
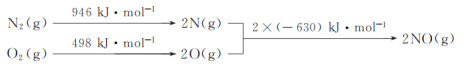
则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为___。
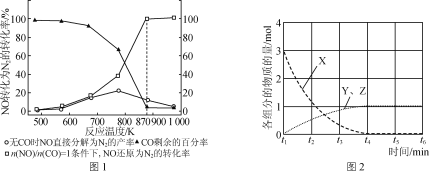
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____。
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:______。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是____。
②由图3可知SO2对NO的氧化率影响很小的原因是_____。
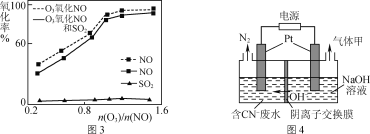
(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:_____。
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是一种非常有潜力的食品添加剂,结构分别如下图所示。下列有关叙述不正确的是
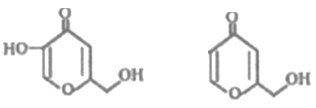
A.曲酸分子中所有碳原子不可能共平面
B.脱氧曲酸能发生酯化反应、氧化反应、还原反应
C.曲酸和脱氧曲酸所含的官能团相同
D.与脱氧曲酸互为同分异构体的芳香族化合物有4种(不考虑O-O键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)。回答下列问题:
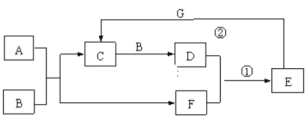
⑴A的电子式为__________。
⑵反应①的化学方程式为_______,该反应的氧化剂和还原剂的物质的量之比为________;
⑶反应②的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小祖的同学设计利用C2H2气体制取H2C2O42H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用如图装置制取C2H2。

①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是____________________________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为________________________。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如图所示:

①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为___________________________________。
③从装置D中得到产品,还需经过__________________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol/L酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定时高锰酸钾标准溶液盛放在滴定管中_____________(填“酸式”或“碱式”)。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是______________ 。
③产品中H2C2O4·2H2O的质量分数为_________________(列出含 m、c、V 的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和 W在元素周期表中的位置如下图所示, 其最外层电子数之和为21。下列说法中正确的是
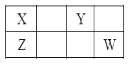
A. 单质W可由海水作原料获得
B. Y 的非金属性比 X的强,所以Y的氢化物一定比 X的更稳定
C. 工业上常利用单质 X与含 Z氧化物的矿石在高温下反应制备高纯 Z
D. X的氢化物可以与 W的单质发生反应,但是不能与 W 的氢化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜片放入 115mL 某浓度的浓硫酸中,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到 2.24L(标准状况下)氢气。过滤残留固体,干燥后称量,质量减轻了 7.5g。求原硫酸的物质的量浓度________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com