
| A. | 30℃ | B. | 35℃ | C. | 40℃ | D. | 45℃ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{O_{2},CO_{2},H_{2}O}{→}$Cu2(OH)2CO3$\stackrel{△}{→}$Cu(OH)2 | |
| B. | MgO$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{加热,HCl氛围}{→}$MgCl2(s) | |
| C. | CaCl2(aq)$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{SiO_{2}/高温}{→}$CaSiO3 | |
| D. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用甲醛溶液浸泡海产品保鲜 | |
| B. | 无水乙醇常用作医用消毒剂 | |
| C. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| D. | 做衣服的棉和麻均与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/L的Na2CO3溶液中含有6.02×1022个CO32- | |
| B. | 足量铁粉在0.05molC12中充分燃烧,反应时转移6.02x1022个电子 | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1mol/L | |
| D. | 常温下,将9g铝片投入500mL18.4mol•L-1的硫酸中,产生H2比11.2L多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径A2->C->B2+ | B. | 它们的原子半径C>B>A | ||
| C. | 它们的原子序数A>B>C | D. | 原子最外层上的电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
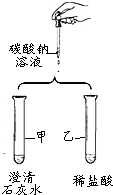 如图是某小组验证碳酸钠性质的实验方案.
如图是某小组验证碳酸钠性质的实验方案.| 实验步骤 | 实验现象 | 结论 |
| 取少量的废液于试管中,滴加2~3滴石蕊试液,振荡. | 无现象 | 废液的pH=7; 猜想Ⅰ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、HCl、H2O、NaOH | B. | Cl2、Na2S、HCl、CO2 | ||
| C. | HBr、CCl4、H2O、CO2 | D. | Na2O2、H2O2、H2O、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H20中含有的分子数为NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05NA | |
| C. | 7.lgCl2 与足量的氢氧化钠溶液反应转移的电子数一定为0.2 NA | |
| D. | 1L lmol/L CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
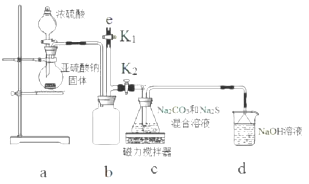
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com