
| A. | 8 | B. | 18 | C. | 8~18 | D. | 18~32 |
分析 根据构造原理知,4s能级大于3p能级而小于3d能级,原子核外电子排列时要遵循能量最低原理,所以排列电子时先排列3p能级再4s能级后排3d能级,且当轨道上电子处于全空、全满或半满时最稳定.
解答 解:根据构造原理知,4s能级大于3p能级而小于3d能级,原子核外电子排列时要遵循能量最低原理,所以排列电子时先排列3p能级再4s能级后排3d能级,且当轨道上电子处于全空、全满或半满时最稳定,某元素原子的N层上只有1或2个电子即4s能级有1个电子或2个电子时,3d能级上可排列电子数是从0到10,所以该原子的第三电子层M电子数可能是8到18,
故选C.
点评 本题考查了基态原子核外电子排布,根据构造原理来分析解答即可,注意Cr和Cu基态原子核外电子排布式的书写特点,为易错点.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
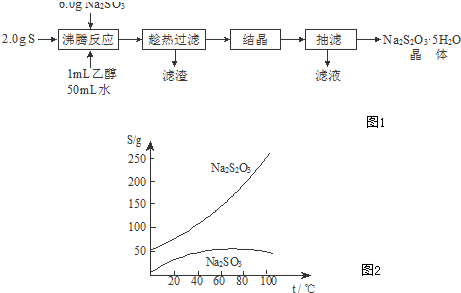
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 | |
| B. | 检验Cl-:确定无SO42-后,加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色 | |
| D. | 检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaHCO3 溶液 | 饱和Na2SO3溶液 | 饱和NaCl溶液 | 水 |
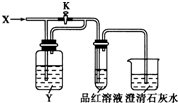
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 |
| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | Fe位于元素周期表第四周期Ⅷ族,是一种过渡金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com