
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | 0.040 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
分析 (1)由表格数据可知,c(N2O4)减少,c(NO2)增大,60min后不再变化,则
N2O4?2NO2,
开始 0.100 0
转化0.06 0.12
平衡0.04 0.12
以此计算转化率;
(2)20s生成,则
N2O4?2NO2,
开始 0.100 0
转化0.03 0.06
20s 0.07 0.06
结合c及v=$\frac{△c}{△t}$计算.
解答 解:(1)由表格数据可知,c(N2O4)减少,c(NO2)增大,60min后不再变化,则
N2O4?2NO2,
开始 0.100 0
转化0.06 0.12
平衡0.04 0.12
达到平衡时四氧化二氮的转化率为$\frac{0.06mol}{0.100mol}$×100%=60%,
故答案为:N2O4?2NO2;60%;
(2)20s生成,则
N2O4?2NO2,
开始 0.100 0
转化0.03 0.06
20s 0.07 0.06
可知20s时四氧化二氮的浓度c1=0.07mol•L-1,在0~20s时间段内,四氧化二氮的平均反应速率为$\frac{0.03mol}{20s}$=0.0015mol•L-1•s-1,
故答案为:0.07;0.0015.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡时各物质浓度、反应速率公式、转化率计算方法为解答的关键,侧重分析与计算能力的考查,注意表格数据的分析与应用,题目难度中等.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁是活泼金属,铁器不能盛装所有酸 | |
| B. | 硫酸铁具有氧化性,它可用于自来水净化和消毒 | |
| C. | 铁具有延展性,可以用铁丝替代铝材料作导线 | |
| D. | 铁红常用于制作红色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO-CH2-CH2-CHO | B. | HOOC-COOH | C. | HO-CH2-CH2-COOH | D. | CH3-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BrCH2CH2CH2CH2CH2Br | B. | 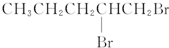 | ||
| C. | 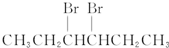 | D. | CH3CH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
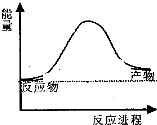 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g),反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
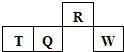 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐T可以出现在酸根中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com