
| A. | 用氨水吸收少量二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | 过量的铁粉与浓硝酸反应:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| D. | 向漂白粉溶液中通入适量SO2:Ca2++2C1O-+SO2+H2O═CaSO3↓+2HC1O |
分析 A.二氧化硫少量,反应生成的是亚硫酸根离子;
B.氢氧化钠过量,铵根离子和碳酸氢根离子都参与反应;
C.铁粉过量,反应生成硝酸亚铁、二氧化氮气体和水;
D.HClO具有强氧化性,能氧化CaSO3为硫酸钙.
解答 解:A.二氧化硫少量,反应生成亚硫酸铵,正确离子方程式为:2NH3•H2O+SO2=2NH4++SO32-+H2O,故A错误;
B.氢氧化钠过量,碳酸氢根离子也参与反应,正确离子方程式为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-,故B错误;
C.过量的铁粉与浓硝酸反应生成硝酸亚铁、二氧化氮和水,反应的离子方程式为:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O,故C正确;
D.二者发生氧化还原反应,二氧化硫少量时的离子方程式为:Ca2++3ClO-+H2O+SO2═CaSO4↓+2HClO+Cl-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
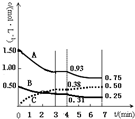 有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为3A(g)+B(g)═2C(g) | |
| B. | 若将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 | |
| C. | 若第4 min 时降低温度,到7 min时达到了新的平衡,则此反应的△H<0 | |
| D. | 反应在前3 min的平均反应速率υ(A)=0.31mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
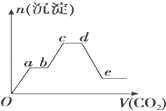 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | ab段与cd段沉淀质量都不变,但所发生的反应不相同 | |
| C. | bc段反应的离子方程式是:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| D. | de段沉淀减少是由于Al(OH)3固体消失的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
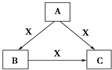 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若X为O2,则A可为硫化氢 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为Cl2,则C可为FeCl3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
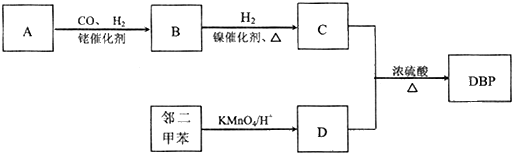
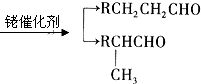
 .
.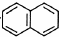 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过灼热的铁粉 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 将Zn片放入CuSO4溶液 | D. | 铝与MnO2发生铝热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com