
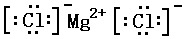 ; ②NaOH
; ②NaOH ;
;分析 (1)${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H的质子数均为1,中子数不同;16O2、18O3为O元素的不同单质;
(2)氯化镁为只含离子键的离子化合物,NaOH含离子键和共价键;
(3)乙炔含碳碳三键、C-H键,水中只含O-H键;
(4)焓变等于断裂化学键吸收的能量减去成键释放的能量,结合物质的状态、焓变书写热化学方程式.
解答 解:(1)${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H的质子数均为1,中子数不同,互为同位素;16O2、18O3为O元素的不同单质,二者互为同素异形体,故答案为:A;C;
(2)氯化镁为只含离子键的离子化合物,NaOH含离子键和共价键,电子式分别为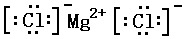 、
、 ,
,
故答案为: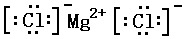 ;
; ;
;
(3)乙炔含碳碳三键、C-H键,水中只含O-H键,结构式分别为H-C≡C-H、H-O-H,
故答案为:H-C≡C-H;H-O-H;
(4)焓变等于断裂化学键吸收的能量减去成键释放的能量,△H=(946KJ/mol)+(436KJ)×3-(391KJ/mol)×6=-92kJ/mol,结合物质的状态、焓变可知热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol.
点评 本题考查热化学方程式、电子式、结构式,为高频考点,把握反应中能量变化、化学用语为解答的关键,侧重分析与应用能力的考查,注意化学用语的规范使用,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | D、E的气态氢化物的热稳定性:D>E | |
| C. | C可与另外四种元素能够分别形成单原子核阴离子的离子化合物 | |
| D. | A与B、C与B均能形成X2Y2型化合物,且其中所含有的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气反应:CH4+Cl2$\stackrel{高温}{→}$CH3Cl+HC1(加成反应) | |
| B. | 乙烯与水在一定条件下生成乙醇:CH2=CH2+H2O$→_{一定条件}^{催化剂}$C3CH2OH(加成反应) | |
| C. | 麦芽糖制葡萄糖:$\stackrel{{C}_{12}{H}_{22}{O}_{11}}{麦芽糖}$+H2O$\stackrel{稀硫酸}{→}$$\stackrel{2{C}_{6}{H}_{12}{O}_{6}}{葡萄糖}$(氧化反应) | |
| D. | 乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+3NH3+2Ag↓+H2O(取代反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L己烷含有分子的数目为0.1NA | |
| D. | 1mol甲基所含的电子数目为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在卤化氢中HF最稳定 | B. | HCl的电子式为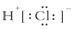 | ||
| C. | 一个D2O分子所含的中子数为8 | D. | 稳定性:H2S>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向稀硝酸中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[AI(OH)4]-+4NH4+ | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ce元素位于元素周期表第六周期第IIIB族 | |
| B. | ${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
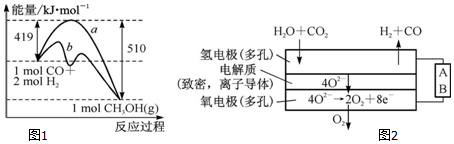
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com