
金属钠与水反应的实验现象:钠浮在水面上,熔成闪亮的 ,并向四周 ,向反应后的溶液中滴加酚酞试液,溶液会变 色,写出该反应的化学方程式 .
考点:
钠的化学性质.
专题:
几种重要的金属及其化合物.
分析:
钠与水发生反应2Na+2H2O=2NaOH+H2↑,反应放出大量的热,密度比水小,浮在水面上,钠的熔点较低,熔成一个闪亮的小球,由于各方向产生的氢气不同,小球四处急速游动,溶液呈碱性,溶液会变为红色.
解答:
解:钠与水发生反应2Na+2H2O=2NaOH+H2↑,反应放出大量的热,钠的熔点较低,熔成一个闪亮的小球;
由于各方向产生的氢气不同,小球四处急速游动;
由于生成氢氧化钠,溶液呈碱性,酚酞在碱性条件下呈红色;
故答案为:小球,急速游动,红,2Na+2H2O=2NaOH+H2↑.
点评:
考查钠的性质、钠与水反应现象与解释等,比较基础,注意基础知识的掌握.


科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) |
|
| C. | 电池工作时,电子由正极通过外电路流向负极 |
|
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形 ,该分子是 (填“极性”或“非极性”)分子.
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: .
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) .
(4)f(NH3)5BrSO4可形成两种配合物,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
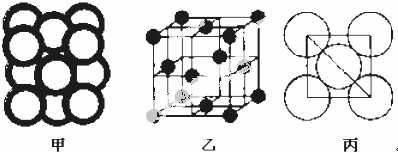
c单质晶体中原子的配位数为 .若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M.该晶体的密度为 (用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )
|
| A. | Na2CO3是碱 | B. | Na2CO3是盐 | C. | Na2CO3是正盐 | D. | Na2CO3是钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1.00L 1.00mol•L﹣1 NaOH溶液与足量的稀盐酸反应,放出 57.4kJ的热量.表示该反应的中和热的热化学方程式正确的是( )
|
| A. | NaOH+HCl═NaCl+H2O△H=+57.4kJ•mol﹣1 |
|
| B. | NaOH+HCl═NaCl+H2O△H=﹣57.4 kJ•mol﹣1 |
|
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ•mol﹣1 |
|
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
|
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ |
|
| B. | 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ |
|
| C. | 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣ |
|
| D. | 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com