
【题目】下列关于元素周期表的叙述中正确的是( )
A.第IA族元素都是金属元素
B.第VIA族元素的单质在常温下均为气体
C.第二、三周期中的金属元素种类一 样多
D.短周期包括第一、二、三周期
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.二氧化锰和浓盐酸反应:MnO2+4HCl浓═Mn2++2Cl2↑+2H2O
B.二氧化硅和氢氧化钠溶液反应:SiO2+2 Na++2OH﹣═Na2SiO3+H2O
C.碳酸钡和稀硝酸反应:CO32﹣+2H+═CO2↑+H2O
D.铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第ⅢB族有_____种元素,第117号元素属于_________元素(填“金属”或“非金属”);
(2)第5周期第ⅤA族元素的元素名称为_________,原子序数为_______;
(3)第4周期元素硒的某一核素含有46个中子,该元素的原子符号为_______;
(4)![]() 和
和![]() 是元素X的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为W g,则
是元素X的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为W g,则![]() 的相对原子质量为___________,元素X的近似相对原子质量为______________________。
的相对原子质量为___________,元素X的近似相对原子质量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[xCuCO3·yCu(OH)2],呈孔雀绿颜色.又称为孔雀石,是一种名贵的矿物宝石。它与铜与空气中的氧气、二氧化碳和水蒸气等物质反应产生的物质。CuSO4溶液与Na2CO3溶液反应可以得到碱式碳酸铜,我们将对其组成进行相关探究。
[沉淀制备]称取12. 5 g胆矾(CuSO4 5H2O)溶于87. 5mL蒸馏水中,滴加少量稀硫酸(体积可以忽略不计),充分搅拌后得到CuSO4溶液。向其中加入Na2CO3溶液,将所得蓝绿色悬浊液过滤,并用蒸馏水洗涤,再用无水乙醇洗涤,最后低温烘干备用。
[实验探究]我们设计了如下装置,用制得的蓝绿色固体进行实验。

根据以上实验回答下列问题
(1)配制硫酸铜溶液的过程中滴加稀硫酸的作用是_______________________________,
所得硫酸铜溶液的溶质质量分数为_____________________。
(2)实验室通常使用加热亚硝酸钠和氯化铵混合溶液的方法制取N2,该反应的化学方程为:__________________________________________________。
(3)D装置加热前,需要首先打开活塞K,通入适量N2,然后关闭K,再点燃D处酒精灯。
C中盛装的试剂应是___________。加热D后观察到的现象是_______________________。
(4)经查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2溶液代替澄清石灰水来定量测定蓝绿色固体的化学式,其原因是(____)
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(5)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是_____________。若装置F中使用Ba(OH)2溶液,实验结束后经称量,装置E的质量增加0.27g,F中产生沉淀1.97g。则该蓝绿色固体的化学式为_____________。[写成xCuCO3·yCu(OH)2的形式]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以水杨酸和甲苯为主要原料,按下列路线合成抗血栓药物﹣﹣新抗凝. 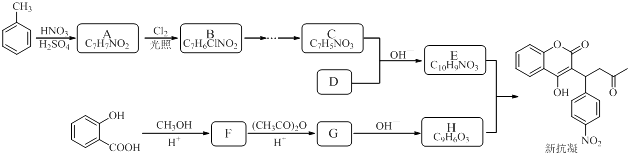
已知: ![]()
RCHO+CH3COR′ ![]() RCH═CHCOR′
RCH═CHCOR′
请回答:
(1)同时符合下列条件的A的所有同分异构体种.
①红光光谱标明分子中含有 ![]() 结构;
结构;
②1H﹣NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子.
(2)设计F→G的化学方程式 .
(3)下列说法不正确的是 .
A.化合物B能使Br2水褪色
B.化合物C能与新制氢氧化铜反应
C.化合物F能与FeCl3发生显色反应
D.新抗凝的分子式为C19H16O6
(4)写出化合物的结构简式:A .
(5)G→H的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期主族元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素,请回答:
(1)D在元素周期表中的位置是____________。
(2)C2B2的电子式是____________;
(3)B、C、E的离子半径由大到小的顺序为_________________(用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为________。
<span style="font-size: 14px; font-family: "Times New Roman";"><span contenteditable="true">(4)</span></span>B的氢化物比同主族的氢化物的熔沸点明显偏高的原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A.用pH试纸测双氧水的pH
B.用酸式滴定管量取20.00 mL酸性KMnO4溶液
C.用托盘天平称取 5.85 g NaCl晶体
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B. 33.6LNO2溶解于足量的水中得到硝酸溶液,溶液中NO3-的数目为NA
C. 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数为2NA
D. 高温下,0.3molFe与足量水蒸气反应,生成的H2分子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+ O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 |
A. 甲中反应的平衡常数小于乙
B. 该温度下,平衡常数值为400
C. 平衡时,丙中c(SO3)是甲中的2倍
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com