
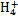 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C 、S
、S 、S
、S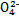 、Cl-、N
、Cl-、N 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
 、Fe2+、S
、Fe2+、S Cl-、Fe3+ 取少量X溶液放入试管中,加入几滴KSCN溶液,溶液不变红色说明无Fe3+,若变红则说明含Fe3+(没有取样、取量扣分)
Cl-、Fe3+ 取少量X溶液放入试管中,加入几滴KSCN溶液,溶液不变红色说明无Fe3+,若变红则说明含Fe3+(没有取样、取量扣分)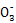 +4H+
+4H+ 3Fe3++NO↑+2H2O Al
3Fe3++NO↑+2H2O Al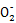 +CO2+2H2O
+CO2+2H2O Al(OH)3↓+HC
Al(OH)3↓+HC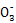
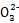 、S
、S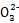 ;在酸性溶液中与Ba(NO3)2溶液混合有沉淀C生成,可知X中含有S
;在酸性溶液中与Ba(NO3)2溶液混合有沉淀C生成,可知X中含有S ,一定无Ba2+;生成气体A只能为NO,所以X中含有还原性物质Fe2+,无N
,一定无Ba2+;生成气体A只能为NO,所以X中含有还原性物质Fe2+,无N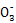 ;溶液B中含有 Fe3+,沉淀G为Fe(OH)3;由气体F可知X中含有N
;溶液B中含有 Fe3+,沉淀G为Fe(OH)3;由气体F可知X中含有N ,由步骤②可知X中含有Al3+;(4)n(NO)="0.01" mol、n(NH3)="0.01" mol、n[Al(OH)3]="0.01" mol、n(H+)="0.04" mol、n(BaSO4)="0.07" mol,依据原子及化合价守恒可知溶液中含有:n(Fe2+)="3n(NO)=0.03" mol、n(N
,由步骤②可知X中含有Al3+;(4)n(NO)="0.01" mol、n(NH3)="0.01" mol、n[Al(OH)3]="0.01" mol、n(H+)="0.04" mol、n(BaSO4)="0.07" mol,依据原子及化合价守恒可知溶液中含有:n(Fe2+)="3n(NO)=0.03" mol、n(N )="0.01" mol、n(Al3+)="0.01" mol、n(H+)="0.04" mol、n(S
)="0.01" mol、n(Al3+)="0.01" mol、n(H+)="0.04" mol、n(S )="0.07" mol,依据电荷守恒2n(Fe2+)+n(N
)="0.07" mol,依据电荷守恒2n(Fe2+)+n(N )+3n(Al3+)+n(H+)="0.14" mol=2n(S
)+3n(Al3+)+n(H+)="0.14" mol=2n(S )
)

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
A.熔融烧碱时,不能使用氧化铝坩埚:Al2O3+2NaOH 2NaAlO2+H2O 2NaAlO2+H2O |
| B.刻制印刷电路时用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=Cu2++2Fe2+ |
C.打磨后的镁条置于沸水中,滴加酚酞溶液变红色:Mg+2H2O(g)  Mg(OH)2+H2↑ Mg(OH)2+H2↑ |
| D.向KI溶液中滴加硫酸酸化的双氧水,溶液呈棕黄色:2I﹣+H2O2+2H+=I2+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验 序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27 g,第二次称量沉淀质量为2.33 g |
| D | 加少量KMnO4酸性溶液 | KMnO4溶液褪色 |
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+ | B.CH3COO- | C.CO32-、NH4+ | D.CH3COO-、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
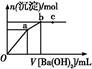
| A.a点时溶液中所含主要溶质为(NH4)2SO4 |
B.a→b段发生反应的离子方程式是:S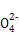 +Ba2+ +Ba2+ BaSO4↓ BaSO4↓ |
| C.b点为最大沉淀量,对应的纵坐标值为0.02 |
| D.c点加入Ba(OH)2溶液的体积为200 Ml |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
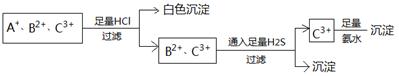
| A.Ag+、Fe2+、Al3+ | B.NH4+、Fe2+、Fe3+ |
| C.Ag+、Cu2+、Fe3+ | D.Ag+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
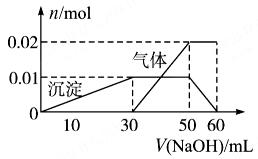
| A.根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L |
| B.根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L |
| C.另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42ˉ同时完全沉淀 |
| D.NH4+、K+、Al3+、SO42ˉ四种离子的物质的量之比为:2:1:1:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com