
 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中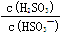 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,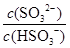 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。 HSO3- + H+的电离常数Ka= {C(H+)·C(HSO3-)} ÷C(H2SO3)= 1×10-2 mol/L; NaHSO3的水解平衡为HSO3-+H2O
HSO3- + H+的电离常数Ka= {C(H+)·C(HSO3-)} ÷C(H2SO3)= 1×10-2 mol/L; NaHSO3的水解平衡为HSO3-+H2O H2SO3 + OH-。水解平衡常数Kh=" {" C(OH-)·C(H2SO3)}÷{ C(HSO3-)·C(H2O)}. Ka·Kh= {C(H+)·C(OH-)}÷C(H2O). Kh= {C(H+)·C(OH-)} ÷{C(H2O)·Ka } =1.0×10-14÷1.0×10-2=1.0×10-12. 若向NaHSO3溶液中加入少量的I2,会发生反应:H2SO3+ I2+H2O= H2SO4+ 2HI;使平衡H2SO3
H2SO3 + OH-。水解平衡常数Kh=" {" C(OH-)·C(H2SO3)}÷{ C(HSO3-)·C(H2O)}. Ka·Kh= {C(H+)·C(OH-)}÷C(H2O). Kh= {C(H+)·C(OH-)} ÷{C(H2O)·Ka } =1.0×10-14÷1.0×10-2=1.0×10-12. 若向NaHSO3溶液中加入少量的I2,会发生反应:H2SO3+ I2+H2O= H2SO4+ 2HI;使平衡H2SO3 HSO3- + H+向逆反应方向移动,则溶液中
HSO3- + H+向逆反应方向移动,则溶液中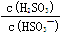 将增大。若加入少量NaOH溶液,由于发生反应:H++OH-= H2O,使平衡HSO3 -
将增大。若加入少量NaOH溶液,由于发生反应:H++OH-= H2O,使平衡HSO3 - SO32- + H+向正反应方向移动,
SO32- + H+向正反应方向移动,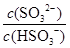 的值增大。若加入少量水,盐的水解程度增大,使水的电离程度也增大。
的值增大。若加入少量水,盐的水解程度增大,使水的电离程度也增大。

 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:不详 题型:单选题
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.每生成55 g K2S转移电子数为6.02×1023 |
| B.S和KNO3均为还原剂 |
| C.反应过程中氮元素被还原 |
| D.CO2为还原产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D.若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NF3分子中所有原子共平面 | B.NF3在反应中既做氧化剂又做还原剂 |
| C.生成0.2mol HNO3时转移0.2mol电子 | D.氧化产物与还原产物的物质的量之比为2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18.0 L | B.27.0 L | C.31.4L | D.33.6 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.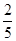 mol mol | B. mol mol | C. mol mol | D. mol mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com