
【题目】离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ①③ B. ①④⑤ C. ①⑤ D. ②④⑤
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 ,
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;② ;洗涤;③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299g/mol)
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
② 产品中Mg(ClO3)2·6H2O的质量分数为 。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是其次外层电子数的一半。
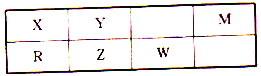
请回答下列问题:
(1)R的元素名称是_______,中子数为8的X元素的原子是______(用原子组成符号表示)。
(2)上述六种元素,非金属性最强的元素为________________(填元素符号)
(3)Z的最高价氧化物对应水化物的化学式为____________________。
(4)W和Y形成一种二元化合物甲的相对分子质量为184,且Y的质量分数约为30%。则化合物甲的化学式为__________________。化合物甲在摩擦时会发生猛烈爆炸,分解为一种W的单质和一种Y的单质,其中W的单质与Y的单质的相对分子质量之比为64∶7。写出化合物甲爆炸分解的化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原铁粉是化工生产及实验室中常用的还原剂。工业上以绿矾为原料制备还原铁粉的工艺如下:
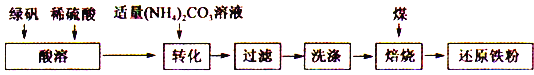
回答下列问题:
(1)酸溶过程中硫酸的作用是________________________ 。
(2)转化的目的是制得FeCO3,加液时应将(NH4)2CO3溶液加入到FeSO4中,原因是_____________。
(3)转化过程中温度不超过35℃,原因是___________________________ 。
(4)生成的FeCO3沉淀需充分洗涤,检验洗涤是否完全的方法是___________________ 。
(5)将FeCO3浊液暴露在空气中,固体表面变为红褐色,同时释放出CO2,写出该反应的化学方程式:________________________ 。
(6)在焙烧过程中需加入CaCO3进行脱硫处理。下图为加CaCO3和不加CaCO3对还原铁粉产率的影响,据图分析CaCO3的另一作用为________________________ 。
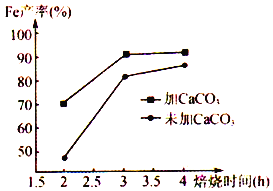
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):阳离子:H+、Na+、Al3+、Ag+、Ba2+ 阴离子:OH﹣、Cl﹣、CO32﹣、NO3﹣、SO42﹣
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
请回答下列问题:
(1)写出A与D的化学式:A , D .
(2)写出A与E溶液反应的离子方程式: .
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=﹣akJmol﹣1 . 请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式: .
(4)若25℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是;将C与醋酸混合,醋酸的电离程度将(填“增大”“不变”或“减小”).
(5)用惰性电极电解0.1molL﹣1 D与0.1molL﹣1C各100mL混合后的溶液,电解一段时间后,阴极质量(填“增大”“不变”或“减小”,下同);溶液的pH .
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取铁粉和氧化铜的混合物6.40g,进行如下实验: 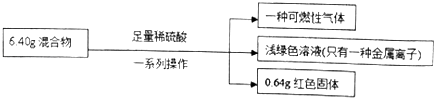
根据实验所得数据,下列说法不正确的是( )
A.原混合物中铜元素的质量一定为0.64g
B.生成气体体积为2.016L
C.实验中反应的硫酸的物质的量为0.1mol
D.原混合物中铁的质量分数为87.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com